摘要:12.选择适当的鉴别.分离或提纯方法. 3胶体中混有的FeCl3和HCl.方法是 . (2)除去澄清石灰水中悬浮的CaCO3.用 . (3)分离油脂皂化反应的产物.用 . 3胶体和浓溴水.用 . (5)除去水泥.冶金工厂里大量烟尘.减少空气污染.用 . (6)除去蛋白质胶体中混有的(NH4)2SO4.用 . (7)分离KNO3和NaCl的固体混合物.用 . 3胶体中加入硅酸胶体后.胶体变浑浊.这是发生了 . 3胶体呈红褐色.插入两个惰性电极.通直流电一段时间.阴极附近颜色变深.这种现象叫 . 答案:盐析 电泳 聚 沉 (9)电泳
网址:http://m.1010jiajiao.com/timu3_id_81343[举报]
现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、NO3-的相互分离.相应的实验过程可用下列流程图表示: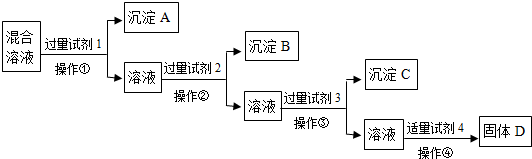
(1)写出上述实验过程中所用试剂的名称:
试剂1
(2)恰当地控制试剂4的加入量的方法是
(3)加入过量试剂3的目的是
(4)在加入试剂4后,获得固体D的实验操作④是
查看习题详情和答案>>

(1)写出上述实验过程中所用试剂的名称:
试剂1
BaCl2[或Ba(NO3)2]
BaCl2[或Ba(NO3)2]
试剂2AgNO3
AgNO3
试剂4稀HNO3
稀HNO3
(2)恰当地控制试剂4的加入量的方法是
测定溶液pH
测定溶液pH
(3)加入过量试剂3的目的是
除去溶液中过量的Ag+、Ba2+
除去溶液中过量的Ag+、Ba2+
(4)在加入试剂4后,获得固体D的实验操作④是
蒸发、冷却、结晶、过滤
蒸发、冷却、结晶、过滤
(填操作名称).现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离.相应的实验过程可用下图表示:

请回答下列问题:
(1)写出实验流程中下列物质的化学式.试剂X:
(2)上述实验流程中加入过量的Na2CO3的目的是
(3)按此实验方案得到的溶液3中肯定含有
(4)写出实验流程①②所涉及的离子方程式.
①
查看习题详情和答案>>

请回答下列问题:
(1)写出实验流程中下列物质的化学式.试剂X:
BaCl2或Ba(NO3)2
BaCl2或Ba(NO3)2
,沉淀A:BaSO4
BaSO4
,试剂Y:AgNO3
AgNO3
,沉淀B:AgCl
AgCl
.(2)上述实验流程中加入过量的Na2CO3的目的是
使溶液中的Ag+、Ba2+完全沉淀
使溶液中的Ag+、Ba2+完全沉淀
.(3)按此实验方案得到的溶液3中肯定含有
Na2CO3
Na2CO3
(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的稀HNO3
稀HNO3
,之后若要获得固体NaNO3需进行的实验操作是蒸发
蒸发
(填操作名称).(4)写出实验流程①②所涉及的离子方程式.
①
Ba2++SO42-=BaSO4↓
Ba2++SO42-=BaSO4↓
;②Cl-+Ag+=AgCl↓
Cl-+Ag+=AgCl↓
. (2010?西城区二模)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下.
(2010?西城区二模)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下.(1)以N2和H2为原料合成氨气.反应:N2(g)+3H2(g)?2NH3(g)△H<0.
①下列措施可以提高H2的转化率的是(填选项序号)
bc
bc
.a.选择适当的催化剂
b.增大压强
c.及时分离生成的NH3
d.升高温度
②一定温度下,在密闭容器中充入1mol N2和3mol H2发生反应.若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的
| 15 |
| 16 |
12.5%
12.5%
;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2>
>
α1(填“>”、“<”或“=”).(2)以氨气、空气为主要原料制硝酸.
①NH3被氧气催化氧化生成NO的反应的化学方程式是
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
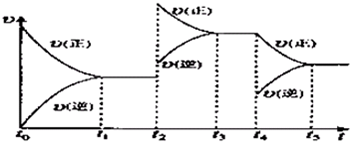
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)?2NO2(g)△H>0.该反应的反应速率(υ)随时间(t)变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)
ab
ab
.a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
(3)硝酸厂常用如下2种方法处理尾气.
①催化还原法:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是
4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.9kJ/mol
4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.9kJ/mol
.②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.若每9.2g NO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是
2NO2+CO32-=NO3-+NO2-+CO2
2NO2+CO32-=NO3-+NO2-+CO2
.硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气.反应N2(g)+3H2(g)?2NH3(g)△H<0
①下列措施可以提高H2的转化率是(填选项序号) .
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应.若容器容积恒定,达到平衡状态时,容器内的压强是原来的
,则N2的转化率a1= ;
若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2 a1(填“>”、“<”或“=”).
(2)以氨气、空气为主要原料制硝酸.
①NH3被氧气催化氧化生成NO的反应的化学方程式是 .
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)?2NO2(g)△H>0
该反应的反应速率(v)随时间(t)变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) .
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
③向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2发生反应:
2NO2 (g)?N2O4(g)△H<0.恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1,a2.已知T1<T2,则a1 a2
A.大于 B.小于 C.等于 D.以上都有可能
(3)硝酸厂常用如下2种方法处理尾气.
①催化还原法:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.5kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 .
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.
若每9.2gNO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是 .
查看习题详情和答案>>

(1)以N2和H2为原料合成氨气.反应N2(g)+3H2(g)?2NH3(g)△H<0
①下列措施可以提高H2的转化率是(填选项序号)
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应.若容器容积恒定,达到平衡状态时,容器内的压强是原来的
| 15 | 16 |
若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2
(2)以氨气、空气为主要原料制硝酸.
①NH3被氧气催化氧化生成NO的反应的化学方程式是
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)?2NO2(g)△H>0
该反应的反应速率(v)随时间(t)变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
③向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2发生反应:
2NO2 (g)?N2O4(g)△H<0.恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1,a2.已知T1<T2,则a1
A.大于 B.小于 C.等于 D.以上都有可能
(3)硝酸厂常用如下2种方法处理尾气.
①催化还原法:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.5kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.
若每9.2gNO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是
