网址:http://m.1010jiajiao.com/timu3_id_81211[举报]
(6分)某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验: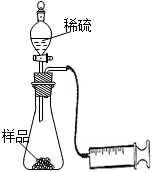
(1)在一个质量为ag的蒸发皿中加入一些样品,称得总质量为bg。用酒精灯对其充分加热,冷却后称得其总质量为cg。残留在蒸发皿中的固体是(填化学式)_________。
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。打开活塞逐滴加入稀硫酸,至没有气泡产生为止。针筒中收集到气体折算成标准状况下的体积为VmL(滴入稀硫酸的体积及针筒活塞的内壁的摩擦力忽略不计)。该科研小组设称取的每份样品中的Na2CO3、NaHCO3的物质的量分别为x、y,且没有利用化学方程式进行计算,就列出了如下算式:x+y=VmL/22400mL·mol—1,他们依据的原理是_________。根据相似原理,请完成下列算式:2x+y=__________由上述两算式,该科研小组通过计算,得出了样品中的Na2CO3、NaHCO3的质量分数。
(4分)某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验: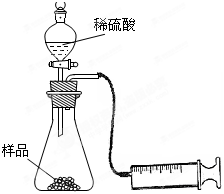
(1)在一个质量为ag的蒸发皿中加入一些样品,称得总质量为bg。用酒精灯对其充分加热,冷却后称得其总质量为cg。残留在蒸发皿中的固体是(填化学式)_________。
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。为了保证实验成功,所选用针筒的最大刻度值应大于或等于_________(mL)。(设实验在标准状况下进行,请把合适的答案编号都挑选出来)
| A.[(b-a)/84]×22.4×1000 mL |
| B.[(b-c)/31]×22.4×1000 mL |
| C.[(c-a)/106]×22.4×1000 mL |
| D.[(c-a)/106]×2×22.4×1000 mL |
(4分)某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
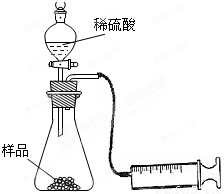
(1)在一个质量为ag的蒸发皿中加入一些样品,称得总质量为bg。用酒精灯对其充分加热,冷却后称得其总质量为cg。残留在蒸发皿中的固体是(填化学式)_________。
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。为了保证实验成功,所选用针筒的最大刻度值应大于或等于_________(mL)。(设实验在标准状况下进行,请把合适的答案编号都挑选出来)
A.[(b-a)/84]×22.4×1000 mL
B.[(b-c)/31]×22.4×1000 mL
C.[(c-a)/106]×22.4×1000 mL
D.[(c-a)/106]×2×22.4×1000 mL
查看习题详情和答案>>
(6分)某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
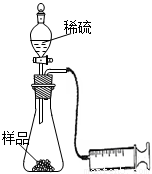
(1)在一个质量为ag的蒸发皿中加入一些样品,称得总质量为bg。用酒精灯对其充分加热,冷却后称得其总质量为cg。残留在蒸发皿中的固体是(填化学式)_________。
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。打开活塞逐滴加入稀硫酸,至没有气泡产生为止。针筒中收集到气体折算成标准状况下的体积为VmL(滴入稀硫酸的体积及针筒活塞的内壁的摩擦力忽略不计)。该科研小组设称取的每份样品中的Na2CO3、NaHCO3的物质的量分别为x、y,且没有利用化学方程式进行计算,就列出了如下算式:x+y=VmL/22400mL·mol—1,他们依据的原理是_________。根据相似原理,请完成下列算式:2x+y=__________由上述两算式,该科研小组通过计算,得出了样品中的Na2CO3、NaHCO3的质量分数。
查看习题详情和答案>>
(4分)某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
(1)在一个质量为ag的蒸发皿中加入一些样品,称得总质量为bg。用酒精灯对其充分加热,冷却后称得其总质量为cg。残留在蒸发皿中的固体是(填化学式)_________。
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。为了保证实验成功,所选用针筒的最大刻度值应大于或等于_________(mL)。(设实验在标准状况下进行,请把合适的答案编号都挑选出来)
A.[(b-a)/84]×22.4×1000 mL
B.[(b-c)/31]×22.4×1000 mL
C.[(c-a)/106]×22.4×1000 mL
D.[(c-a)/106]×2×22.4×1000 mL
查看习题详情和答案>>
