摘要:15.2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如右图所示.已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1. 请回答下列问题: (1)图中A.C分别表示 . .E的大小对该反应的反应热有无影响? . 该反应通常用V2O5作催化剂.加V2O5会使图中B点升高还是降低? .理由是 . (2)图中ΔH= kJ·mol-1, (3)V2O5的催化循环机理可能为:V2O5氧化SO2时.自身被还原为四价钒化合物,四价钒化合物再被氧气氧化.写出该催化循环机理的化学方程式 , (4)如果反应速率v(SO2)为0.05 mol·L-1·min-1.则v(O2)= mol·L-1·min-1.v(SO3)= mol·L-1·min-1, (5)已知单质硫的燃烧热为296 kJ·mol-1.计算由S(s)生成3 mol SO3(g)的ΔH . 解析:(1)由图像很容易得出.纵坐标表示各种物质的能量.E是反应所必经的一个过渡状态的能量变化.它只影响反应的难易程度.而整个反应过程的反应热只与反应的始终态有关.得出没有影响的结论.加入催化剂改变了反应历程.使活化能降低. (2)中的ΔH可根据已知1 mol SO2参加反应时放热99 kJ.而图像中表示的是2SO2反应.所以99 kJ要乘以2. (3)化学方程式根据元素守恒即可写出. (4)考查速率之比和化学方程式中各物质的计量数成正比. (5)考查盖斯定律的应用.考查燃烧热的概念必须是1 mol S(s)完全燃烧. 答案:(1)反应物总能量 生成物总能量 没有影响 降低 因为催化剂改变了反应历程.使活化能E降低 SO2+V2O5===SO3+2VO2 4VO2+O2===2V2O5 (4)0.025
网址:http://m.1010jiajiao.com/timu3_id_80861[举报]
(10分)一定的温度下向2L密闭容器中通入2molSO2和2molO2,发生反
应: 2SO2+O2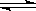 2SO3.5min后达到平衡,测得容器中有SO31.6mol.
2SO3.5min后达到平衡,测得容器中有SO31.6mol.
回答下列问题:
(1) 反应5min内,v(O2)=_________mol.L-1.min-1.
(2) 化学反应达到平衡时,SO2消耗的浓度占起始浓度的百分比为__________;此时,容器中c(O2)=_______,压强是起始时的_______倍.
(3) 判断该反应达到平衡的标志是_______________;
A.v消耗(SO2)=v生成(SO3) B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变 D.容器中气体的总物质的量不再变化
查看习题详情和答案>>
下列表格中的各种情况,可以用右图的曲线表示的是
| 反 应 | 纵坐标 | 甲 | 乙 | |
| A | 相同质量的氨,在同一容器中 2NH3 | 氨气的转化率 | 500℃ | 400℃ |
| B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
| C | 在体积可变的恒压容器中,体积比1︰3的N2、H2, N2 + 3H2 | 氨气的浓度 | 活性高的 催化剂 | 活性一般的催化剂 |
| D | 2 molSO2和1 molO2,在相同温度下2SO2+ O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
以下是反应2SO2+O2 2SO3在不同条件下进行时SO2的转化率:
2SO3在不同条件下进行时SO2的转化率:
从上表中你得到的启示?
(1)关于可逆反应的限度:
(2)提高该化学反应限度的途径有:
(3)要实现SO2的转化率为93.5%需控制的反应条件是
查看习题详情和答案>>
 2SO3在不同条件下进行时SO2的转化率:
2SO3在不同条件下进行时SO2的转化率:| 温度\压强 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 89.5 | 96.4 |
(1)关于可逆反应的限度:
可逆反应中的反应物不能全部转化成生成物;(或可逆反应中的逆反应速率与正反应速率相等时,生成物和反应物的浓度不再改变,该反应就达到了一定的限度;或改变反应条件可以改变化学反应限度等)
可逆反应中的反应物不能全部转化成生成物;(或可逆反应中的逆反应速率与正反应速率相等时,生成物和反应物的浓度不再改变,该反应就达到了一定的限度;或改变反应条件可以改变化学反应限度等)
.(2)提高该化学反应限度的途径有:
增大压强或在一定范围内降低温度
增大压强或在一定范围内降低温度
.(3)要实现SO2的转化率为93.5%需控制的反应条件是
温度为500℃,压强为0.1MPa
温度为500℃,压强为0.1MPa
.在一定条件下,向体积为2L的容器中加入2mol O2和3mol SO2使之反应生成SO3气体:2SO2+O2 2SO3,2min时,测得O2的物质的量为1.6mol,则:
2SO3,2min时,测得O2的物质的量为1.6mol,则:
(1)2min内,平均反应速率v(O2)=
(2)2min时,SO2的浓度为
(3)若2min时测得上述反应放出Q kJ的热量,试写出该反应的热化学方程式
查看习题详情和答案>>
 2SO3,2min时,测得O2的物质的量为1.6mol,则:
2SO3,2min时,测得O2的物质的量为1.6mol,则:(1)2min内,平均反应速率v(O2)=
0.1mol/(L?min)
0.1mol/(L?min)
; v(SO3)=0.2mol/(L?min)
0.2mol/(L?min)
.(2)2min时,SO2的浓度为
1.1mol/L
1.1mol/L
(3)若2min时测得上述反应放出Q kJ的热量,试写出该反应的热化学方程式
2SO2(g)+O2(g) 2SO3(g)△H=-2.5QkJ?mol-1
2SO3(g)△H=-2.5QkJ?mol-1
 2SO3(g)△H=-2.5QkJ?mol-1
2SO3(g)△H=-2.5QkJ?mol-12SO2(g)+O2(g) 2SO3(g)△H=-2.5QkJ?mol-1
2SO3(g)△H=-2.5QkJ?mol-1
. 2SO3(g)△H=-2.5QkJ?mol-1
2SO3(g)△H=-2.5QkJ?mol-1 2SO3,下列说法错误的是( )
2SO3,下列说法错误的是( )