摘要: 反应①1 000KAB+C ②500KDE+F它们的反应速率关系是( ) A.①>② B.①<② C.①=② D.无法确定 解析:决定反应速率的主要因素是反应物本身的性质.因此不同的反应其速率的大小条件是决定不了的. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_80827[举报]
已知A的产量通常用来衡量一个国家的石油化工水平,A能发生以下转化:

(1)A的结构简式为:
(2)写出B、D化合物中官能团:B中含官能团
(3)写出反应的化学方程式
①:
②:
查看习题详情和答案>>

(1)A的结构简式为:
CH2=CH2
CH2=CH2
(2)写出B、D化合物中官能团:B中含官能团
羟基-OH
羟基-OH
;D中含官能团羧基-COOH
羧基-COOH
;(3)写出反应的化学方程式
①:
CH2=CH2+H2O→
CH3CH2OH
| 一定条件 |
CH2=CH2+H2O→
CH3CH2OH
反应类型:| 一定条件 |
加成反应
加成反应
②:
2CH3CH2OH+O2
2CH3CHO+2H2O
| Cu |
| △ |
2CH3CH2OH+O2
2CH3CHO+2H2O
反应类型:| Cu |
| △ |
氧化反应
氧化反应
.(2013?盐城一模)碳酸镁晶须是一种新型吸波隐形材料中的增强材料.
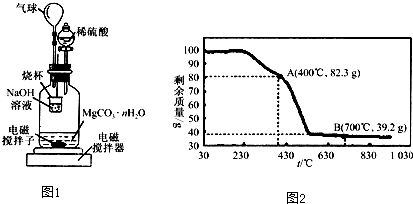
(1)合成碳酸镁晶须的步骤如下:
步骤1.配制0.5mol?L-1MgSO4溶液和0.5mol?L-1NH4HCO3溶液.
步骤2.量取500mL NH4HCO3溶液于1 000mL四口烧瓶中,开启搅拌器.温度控制在50℃.
步骤3.将250mL MgSO4溶液逐滴加入NH4HCO3溶液中,用氨水调节溶液pH到9.5.
步骤4.放置1h后,过滤,洗涤干净.
步骤5.在40℃的真空干燥箱中干燥10h,得碳酸镁晶须产品(MgCO3?nH2O n=1~5).
①步骤2控制温度在50℃,较好的加热方法是
②步骤3生成MgCO3?nH2O沉淀的离子方程式为
⑧步骤4检验沉淀已经洗涤干净的方法是
(2)测定合成的MgCO3?nH2O中的n值.
称量1.000g碳酸镁晶须,放入图所示的广口瓶中,加入水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后,烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次.
①图中气球的作用是
②上述反应后期要升温到30℃,主要目的是
③设3次实验测得每1.000g碳酸镁晶须产生的CO2平均值为a mol,则n值为
(用含a的代数式表示).
(3)称取100g上述晶须产品进行热重分析,热重曲线如图2,则该条件下合成的晶须中,n=
查看习题详情和答案>>

(1)合成碳酸镁晶须的步骤如下:
步骤1.配制0.5mol?L-1MgSO4溶液和0.5mol?L-1NH4HCO3溶液.
步骤2.量取500mL NH4HCO3溶液于1 000mL四口烧瓶中,开启搅拌器.温度控制在50℃.
步骤3.将250mL MgSO4溶液逐滴加入NH4HCO3溶液中,用氨水调节溶液pH到9.5.
步骤4.放置1h后,过滤,洗涤干净.
步骤5.在40℃的真空干燥箱中干燥10h,得碳酸镁晶须产品(MgCO3?nH2O n=1~5).
①步骤2控制温度在50℃,较好的加热方法是
水浴加热
水浴加热
.②步骤3生成MgCO3?nH2O沉淀的离子方程式为
Mg2++HCO3-+NH3?H2O+(n-1)H2O═MgCO3?nH2O+NH4+
Mg2++HCO3-+NH3?H2O+(n-1)H2O═MgCO3?nH2O+NH4+
.⑧步骤4检验沉淀已经洗涤干净的方法是
取最后一次洗涤的滤出液,滴入盐酸酸化的BaCl2溶液,若无沉淀说明已洗涤干净
取最后一次洗涤的滤出液,滴入盐酸酸化的BaCl2溶液,若无沉淀说明已洗涤干净
.(2)测定合成的MgCO3?nH2O中的n值.
称量1.000g碳酸镁晶须,放入图所示的广口瓶中,加入水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后,烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次.
①图中气球的作用是
缓冲压强并封闭体系
缓冲压强并封闭体系
.②上述反应后期要升温到30℃,主要目的是
使广口瓶内水中溶解的CO2充分逸出,并被NaOH充分吸收
使广口瓶内水中溶解的CO2充分逸出,并被NaOH充分吸收
.③设3次实验测得每1.000g碳酸镁晶须产生的CO2平均值为a mol,则n值为
| (1-84a) |
| 18a |
| (1-84a) |
| 18a |
(3)称取100g上述晶须产品进行热重分析,热重曲线如图2,则该条件下合成的晶须中,n=
1
1
(填“1”“2”“3”“4”或“5”).现有50ml、pH都等于2的四种溶液:①HCl②CH3COOH③HNO3④H2SO4
(1)溶液中含有两种分子的是: (填序号,下同)
(2)加入锌粉,无氢气产生的是
(3)在四种溶液中同时加入同质量的锌粉(足量),经充分与酸反应后,放出氢气最多的是
(4)在与锌完全反应时, 与 消耗锌的质量相同.
(5)分别加入50mlpH=12的NaOH溶液, 反应后溶液的pH最小.
(6) 和 的浓溶液混合后(按一定比例),几乎可溶解所有金属.
查看习题详情和答案>>
(1)溶液中含有两种分子的是:
(2)加入锌粉,无氢气产生的是
(3)在四种溶液中同时加入同质量的锌粉(足量),经充分与酸反应后,放出氢气最多的是
(4)在与锌完全反应时,
(5)分别加入50mlpH=12的NaOH溶液,
(6)
铅蓄电池的电池反应为:2PbSO4(s)+2H2O(l)
Pb(s)+PbO2(s)+2H2SO4(aq).下面关于铅蓄电池的一些说法:
①放电反应是自发反应,充电反应是电解反应;
②反应(1)是充电反应,反应(2)是放电反应;
③在充电时,电池中硫酸的浓度不断变小;
④在放电时,该电池的负极材料是铅板;
⑤在放电时,正极发生的反应是:Pb(s)+SO42-(aq)-2e-=PbSO4(s);
⑥在充电时,阳极发生的反应是:PbSO4(s)+2e-=Pb(s)+SO42-(aq).
下列各选项中所包括的说法都正确的是( )
| 反应(1) |
| 反应(2) |
①放电反应是自发反应,充电反应是电解反应;
②反应(1)是充电反应,反应(2)是放电反应;
③在充电时,电池中硫酸的浓度不断变小;
④在放电时,该电池的负极材料是铅板;
⑤在放电时,正极发生的反应是:Pb(s)+SO42-(aq)-2e-=PbSO4(s);
⑥在充电时,阳极发生的反应是:PbSO4(s)+2e-=Pb(s)+SO42-(aq).
下列各选项中所包括的说法都正确的是( )
| A、①③⑤ | B、②④⑥ |
| C、③⑤⑥ | D、①②④ |