网址:http://m.1010jiajiao.com/timu3_id_8060[举报]
【研究课题】探究热水壶底部水垢的主要成分
【查阅资料】该小组同学通过查阅资料知道:
①天然水中一般都含有Ca2+、Mg2+、HC
| O | - 3 |
②在加热条件下,这些离子趋于生成溶解度更小的物质,即水垢.(主要成分为碳酸盐、碱等物质的混合物).
③碱石灰的化学成分是CaO与NaOH的混合物,可吸收水分和酸性气体(如二氧化碳).
④有关物质的溶解性如下:
| 物质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
【设计方案】(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,取上层清液加入
(2)乙同学设计了下列实验装置,进一步确定水垢中是否含有碳酸盐的成分.其主要实验步骤如下:
①按下图组装仪器,检查装置气密性,再将50g水垢试样放入锥形瓶中,并加入足量某酸溶液;
②测量一定时间内干燥管内物质增加的质量;
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓放入一定量的空气;
④再次称量干燥管内物质增加的质量;
⑤重复③和④的操作,直至干燥管内物质质量不变,并称得干燥管质量增加了24g.

讨论:
a.步骤①所加的酸溶液是
b.从导管A处缓缓鼓入一定量的空气时,装置Ⅰ的作用是
c.研究性学习小组的同学通过简单计算,认为水垢中一定含有MgCO3,理由是
【实验结论】通过上述探究可知:水垢的主要成分有
 (2008?东城区二模)实验室有一瓶未开启的浓盐酸,标签部分内容如图所示,请回答下列问题:
(2008?东城区二模)实验室有一瓶未开启的浓盐酸,标签部分内容如图所示,请回答下列问题:(1)这瓶浓盐酸的质量为
(2)若用这瓶浓盐酸配制200g 10%的稀盐酸,需要取浓盐酸的质量为多少克?(请写出计算过程)
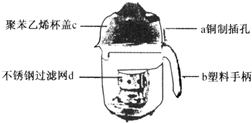 (2008?东城区一模)(1)豆浆机由于快捷方便而进入千家万户.请根据下列某全自动家用豆浆机图示回答:
(2008?东城区一模)(1)豆浆机由于快捷方便而进入千家万户.请根据下列某全自动家用豆浆机图示回答:①制作材料中属于金属以及合金的是
②用铜制材料制作电源插头的插孔是利用铜具有
(2)豆浆已成为众多家庭的早餐必备饮品,下表是豆浆中一些成分的平均质量分数:
| 成分 | 水 | 蛋白质 | 脂肪 | 糖类 |
| 质量分数/% | 96.0 | 1.8 | 0.7 | 1.1 |
| 成分 | 钙 | 磷 | 铁 | 维生素A |
| 质量分数/% | 0.01 | 0.33 | 0.0005 | 0.015 |
②若成年人每天饮用250mL的豆浆(密度以1g/cm3计算),则摄入钙的质量为
A.甲状腺肿大 B.佝偻病 C.贫血 D.夜盲症.
(2008年盐城市)一化学兴趣小组对某生铁样品中铁的质量分数进行探究。请按要求完成下列探究报告。
[实验目的]
测定某生铁样品中单质铁的质量分数。
[资料支撑]
生铁中除铁外,还含有碳、硅、锰、磷和硫等元素。碳在生铁中以两种形态存在,一种是游离碳(石墨),另一种是化合碳(如Fe3C等);硅、锰、磷、硫存在形式较为复杂;这些物质通常都不与稀硫酸发生化学反应。
[实验方案]
生铁样品与过量的稀硫酸反应,测定反应前后可称量物质的质量差。
[实验过程]
(1)取一只烧杯,称得其质量为70.4g,加入一定量生铁样品碎屑,称得烧杯和样品的总质量为102.4g;
(2)向盛有生铁样品的烧杯中加入稀硫酸,边加边搅拌,直到烧杯中不再产生气泡,再加入少量稀硫酸以确保过量,测得共用去稀硫酸247.3g;
(3)静置,称量。称得烧杯和剩余物质的总质量为348.7g。
[数据处理]
计算该生铁样品中单质铁的质量分数:____________
[交流讨论]
(1)实验称量时称量物应放在托盘天平的______盘(选填“左”或“右”);
(2)实验过程中稀硫酸要过量的原因是______________________________;
(3)经质检部门精确测定,该样品中铁元素的总含量为95.2%。假设没有与硫酸反应的铁都以Fe3C形式存在,则样品中Fe3C的质量分数为__________________。
查看习题详情和答案>>(2008年盐城市)一化学兴趣小组对某生铁样品中铁的质量分数进行探究。请按要求完成下列探究报告。
[实验目的]
测定某生铁样品中单质铁的质量分数。
[资料支撑]
生铁中除铁外,还含有碳、硅、锰、磷和硫等元素。碳在生铁中以两种形态存在,一种是游离碳(石墨),另一种是化合碳(如Fe3C等);硅、锰、磷、硫存在形式较为复杂;这些物质通常都不与稀硫酸发生化学反应。
[实验方案]
生铁样品与过量的稀硫酸反应,测定反应前后可称量物质的质量差。
[实验过程]
(1)取一只烧杯,称得其质量为70.4g,加入一定量生铁样品碎屑,称得烧杯和样品的总质量为102.4g;
(2)向盛有生铁样品的烧杯中加入稀硫酸,边加边搅拌,直到烧杯中不再产生气泡,再加入少量稀硫酸以确保过量,测得共用去稀硫酸247.3g;
(3)静置,称量。称得烧杯和剩余物质的总质量为348.7g。
[数据处理]
计算该生铁样品中单质铁的质量分数:____________
[交流讨论]
(1)实验称量时称量物应放在托盘天平的______盘(选填“左”或“右”);
(2)实验过程中稀硫酸要过量的原因是______________________________;
(3)经质检部门精确测定,该样品中铁元素的总含量为95.2%。假设没有与硫酸反应的铁都以Fe3C形式存在,则样品中Fe3C的质量分数为__________________。
查看习题详情和答案>>