摘要:估计68的立方根的大小在( ) A.2与3之间 B.3与4之间 C.4与5之间 D.5与6之间
网址:http://m.1010jiajiao.com/timu3_id_8051[举报]
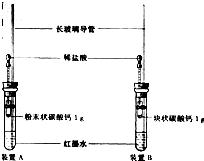 28、小明按如图装好了实验装置(两胶头滴管中的稀盐酸浓度和体积都相等),实验时,同时完全捏扁两滴管的胶头,并观察实验现象.
28、小明按如图装好了实验装置(两胶头滴管中的稀盐酸浓度和体积都相等),实验时,同时完全捏扁两滴管的胶头,并观察实验现象.(1)小明的实验目的是:
比较粉末状和块状的碳酸钙和同浓度、同体积盐酸反应的速率的大小.
.(2)装置中细长玻璃导管的作用是:
相同的液体体积变化在细长的玻璃导管中造成的液面高度变化大,便于观察
;红墨水的作用是
导管中的液柱呈现红色,便于观察导管中液面高度的变化
.(3)你估计两根玻璃导管中的实验现象是
装置A中导管内液面的上升速度比装置B的快
;理由是
等质量的粉末状碳酸钙与盐酸的接触面积比块状碳酸钙的大,反应速率快,单位时间内产生的气体多,产生的气体压强大
.20、金属活动性顺序在工农业生产和科学研究中有重要应用.现有一化学兴趣小组为探究铁、铜、锌、银的金属活动顺序,设计了如图所示的三个实验(其中金属均已用砂纸打磨过,其形状、大小及同种稀盐酸的用量均相同):

(1)一段时间后,观察到实验B的铜片表面有银白色固体附着,这说明铜比银的活动性
(2)甲同学认为通过观察实验A和C中产生气泡的速率快慢的实验现象来比较锌和铁的金属活动性.但乙同学拟用定量的方法测量锌和铁的活动性强弱.他设计了如图1所示的装置.

①若要比较产生气体的快慢,可以测量相同时间内产生气体的体积,也可以测量
②实验测得锌片产生的气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间内反应速率逐渐加快的主要原因是
(3)丙、丁两位同学认为上述实验方案不足以得出4种金属的活动性顺序,并在上述实验的基础上,利用金属不同的化学性质分别补充了一个实验(如图所示),都实现了探究目的.则:
乙同学的实验:X是金属
丙同学的实验:X是金属
查看习题详情和答案>>

(1)一段时间后,观察到实验B的铜片表面有银白色固体附着,这说明铜比银的活动性
强
(选填“强”或“弱”)(2)甲同学认为通过观察实验A和C中产生气泡的速率快慢的实验现象来比较锌和铁的金属活动性.但乙同学拟用定量的方法测量锌和铁的活动性强弱.他设计了如图1所示的装置.

①若要比较产生气体的快慢,可以测量相同时间内产生气体的体积,也可以测量
产生相同体积的气体所需的时间
②实验测得锌片产生的气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间内反应速率逐渐加快的主要原因是
反应放热,溶液温度升高使反应速率加快

(3)丙、丁两位同学认为上述实验方案不足以得出4种金属的活动性顺序,并在上述实验的基础上,利用金属不同的化学性质分别补充了一个实验(如图所示),都实现了探究目的.则:
乙同学的实验:X是金属
Fe
,Y是CuSO4
溶液丙同学的实验:X是金属
Cu
,Y是FeSO4
溶液.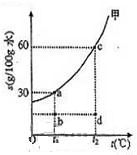 (2010?上海)甲物质在水中的溶解度曲线如图,a、b、c、d为图象中的四个点.
(2010?上海)甲物质在水中的溶解度曲线如图,a、b、c、d为图象中的四个点.①t1℃时,甲物质的溶解度是
30
30
g/100g水.②t2℃时,25g水中最多能溶解甲物质
15
15
g.③要使甲物质的饱和溶液成为不饱和溶液,可采用的一种方法是
升温
升温
.④甲物质的溶液分别处于a、b、c、d四个点时,溶液中甲的质量分
数大小关系正确的是
Ⅲ
Ⅲ
(选填下列编号).Ⅰ.c>d=b>aⅡ.c=d>a=bⅢ.c>a>b=dⅣ.c>a=b>d.
47、一般情况下,金属越活泼,与酸反应的速度越快.为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下的实验.[实验步骤]:
①取A、B、C三支试管,分别加入2mL浓度相同的盐酸溶液;
②分别加入足量的、大小相同的Mg、Zn、Fe,立即把三个相同的气球分别套在各试管口上.
[实验预测与分析]
(1)写出铁与盐酸反应的化学方程式:
(2)气球膨胀速度最快的是
(3)该实验表明,实验室一般选用锌而不选用镁、铁制取氢气的主要原因
(4)步骤②是实验获得成功的关键,你认为在操作过程中小组成员之应该
查看习题详情和答案>>
①取A、B、C三支试管,分别加入2mL浓度相同的盐酸溶液;
②分别加入足量的、大小相同的Mg、Zn、Fe,立即把三个相同的气球分别套在各试管口上.
[实验预测与分析]
(1)写出铁与盐酸反应的化学方程式:
Fe+2HCl=FeCl2+H2↑
.(2)气球膨胀速度最快的是
A
(填试管编号)(3)该实验表明,实验室一般选用锌而不选用镁、铁制取氢气的主要原因
锌反应速度适中,容易控制
.(4)步骤②是实验获得成功的关键,你认为在操作过程中小组成员之应该
迅速并同时完成加入金属和套上气球的操作
.