摘要:5.25℃时.水的电离达到平衡:H2OH++OH-,ΔH>0.下列叙述正确的是( ) A.向水中加入稀氨水.平衡逆向移动.c(OH-)降低 B.向水中加入少量固体硫酸氢钠.c(H+)增大.KW不变 C.向水中加入少量固体CH3COONa.平衡逆向移动.c(H+)减小 D.将水加热.KW增大.pH不变 解析:A项中向水中加入稀氨水后c(OH-)增大.A项错,B项中向水中加入少量固体硫酸氢钠后.c(H+)增大.但KW不变.B项正确,C项中向水中加入少量固体CH3COONa.因CHCOO-结合H+而使水的电离平衡正向移动.C项错,将水加热后.KW增大.pH减小.但仍呈中性.D项错. 答案:B
网址:http://m.1010jiajiao.com/timu3_id_80501[举报]
25 ℃时,水的电离达到平衡:H2O H++OH-;△H>0,下列叙述正确的是
H++OH-;△H>0,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,KW增大,pH不变 |
25 ℃时,水的电离达到平衡:H2O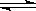 H++OH-;△H>0,下列叙述正确的是
H++OH-;△H>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
查看习题详情和答案>>
25 ℃时,水的电离达到平衡:H2O H++OH-;ΔH>0,下列叙述正确的是( )
H++OH-;ΔH>0,下列叙述正确的是( )
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低? |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变? |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低?? |
| D.将水加热, Kw增大,pH不变 |
 H++OH-;ΔH>0,下列叙述正确的是( )
H++OH-;ΔH>0,下列叙述正确的是( )