摘要:不水解的离子 特殊 离子 能水解的离子 弱酸的酸式酸根离子 阳离子 Na+.K+.Ca2+.Ba2+ H+ NH4+.Ag+.Fe2+.Mg2+.Cu2+.Zn2+.Al3+.Fe3+ 阴离子 Cl-.Br-.I-.NO3-. ClO3-.BrO3-.SCN- SO42-..MnO4- OH- CH3COO-.HCOO-.ClO-. [Al(OH)4]-.NO2-.CO32-.S2-.SO32-..S2O32- HCO3-.HSO3-.HS-.H2PO4-.HPO42- 1.在pH=1的溶液中能大量共存的一组离子或分子是 A.Na+.Mg2+.ClO-.NO3- B. Al3+. NH4+. Br- .Cl- C. K+ .Cr2O72- .CH3CHO. SO42- D. Na+.K+ .SiO32-.Cl-
网址:http://m.1010jiajiao.com/timu3_id_80242[举报]
(2011?漳州一模)纳米氧化镁具有特殊的热、光、电、力学和化学等性能,有广泛的应用前景.如图是利用海水制备纳米氧化镁的流程图.
回答下列问题:
(1)操作I后得到的母液中镁离子浓度为1.8×10-3 mol?L-1,要使镁离子产生沉淀,溶液的pH最低应为
(2)利用MgCl2?6H2O制备无水氯化镁,需在干燥的
(3)反应I中CO(NH2)2与H2O反应生成CO2和NH3?H2O,还发生另一主要化学反应的离子方程式为
(4)某科研小组研究反应I在温度为378K~398K时的反应时间、反应物配比等因素对制备纳米氧化镁产率的影响.请完成以下实验设计表(表中不要留空格):
(5)如图为反应I的温度对纳米MgO产率(曲线a)和粒径(曲线b)的影响,请你归纳出温度对纳米MgO的制备有何影响的结论(至少写出一条):

查看习题详情和答案>>

回答下列问题:
(1)操作I后得到的母液中镁离子浓度为1.8×10-3 mol?L-1,要使镁离子产生沉淀,溶液的pH最低应为
10
10
.(已知:Ksp[MgCO3]=6.8×10-6,Ksp[Mg(OH)2]=1.8×10-11)(2)利用MgCl2?6H2O制备无水氯化镁,需在干燥的
HCl
HCl
气流中加热,原因是MgCl2?6H2O在受热时易发生水解,为抑制其水解,在加热时应不断通入HCl气体
MgCl2?6H2O在受热时易发生水解,为抑制其水解,在加热时应不断通入HCl气体
.(3)反应I中CO(NH2)2与H2O反应生成CO2和NH3?H2O,还发生另一主要化学反应的离子方程式为
Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+
Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+
.(4)某科研小组研究反应I在温度为378K~398K时的反应时间、反应物配比等因素对制备纳米氧化镁产率的影响.请完成以下实验设计表(表中不要留空格):
| 实验 编号 |
T/K | 反应 时间/h |
反应物的物质的量配比 n[CO(NH2)2]:n[MgCl2?6H2O] |
实验目的 |
| ① | 378 | 3 | 3:1 | (Ⅰ)实验①和③探究 反应物的物质的量配比对产率的影响 反应物的物质的量配比对产率的影响 删除此空 删除此空 ;(Ⅱ)实验②和④探究 温度对产率的影响 温度对产率的影响 ;(Ⅲ)实验②和 ③ ③ 探究反应时间对产率的影响. |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | ||
| ④ | 398 | 4 | 4:1 |
在378K~398K,纳米MgO的粒径大小无明显变化
在378K~398K,纳米MgO的粒径大小无明显变化
在383K较低温度下有利于形成较小的颗粒
在383K较低温度下有利于形成较小的颗粒
产率随温度的升高而增大
产率随温度的升高而增大
.
(1)一般所谓“无水”乙醇,含乙醇约99.5%,还有约0.5%的水.当特殊需要而要求进一步除去水时,常采用如下操作:置5g镁条和0.5g碘(碘作催化剂)于一恰当容量的烧瓶中,倾入50~75mL“无水”乙醇,逐渐加热,此时有小气泡不断从混合液中逸出,继续加热回流直至镁条完全溶完,成为乳白色浆液.再倾入900mL“无水”乙醇,回流30min,然后直接蒸出乙醇,这样得到的乙醇其含量可以达到99.95%.试回答:
上述操作应选取的烧瓶的容积为 (选填序号)
(A)2L (B)1L (C)0.5L (D)0.2L
做出以上选择的理由是:
(2)亚硝酸钠可用作水泥施工的抗冻剂.它易溶于水,有咸味,既有氧化性,也有还原性.在酸性溶液中它能氧化碘离子、亚铁离子.亚硝酸钠和酸反应生成亚硝酸,亚硝酸是不稳定且比醋酸的酸性还要弱的弱酸,亚硝酸只能存在于冷的稀溶液中,在浓溶液中或受热时易发生如下的分解反应:3HNO2═2NO↑+HNO3+H2O
从浓醋酸、氨水、纯碱、稀盐酸、碘化钾淀粉溶液中选择适当的物质做试剂,用两种简单的化学实验鉴别亚硝酸钠和氯化钠.试写出两种实验方法所使用的试剂和据以鉴别它们的现象.
方法一(只用一种试剂):
方法二: .
查看习题详情和答案>>
上述操作应选取的烧瓶的容积为
(A)2L (B)1L (C)0.5L (D)0.2L
做出以上选择的理由是:
(2)亚硝酸钠可用作水泥施工的抗冻剂.它易溶于水,有咸味,既有氧化性,也有还原性.在酸性溶液中它能氧化碘离子、亚铁离子.亚硝酸钠和酸反应生成亚硝酸,亚硝酸是不稳定且比醋酸的酸性还要弱的弱酸,亚硝酸只能存在于冷的稀溶液中,在浓溶液中或受热时易发生如下的分解反应:3HNO2═2NO↑+HNO3+H2O
从浓醋酸、氨水、纯碱、稀盐酸、碘化钾淀粉溶液中选择适当的物质做试剂,用两种简单的化学实验鉴别亚硝酸钠和氯化钠.试写出两种实验方法所使用的试剂和据以鉴别它们的现象.
方法一(只用一种试剂):
方法二:
(5)上述方法制备的Fe(OH)2久置也会被氧化,当有1.12 L氧气参与反应时,该氧化过程中转移的电子的物质的量是____。
查看习题详情和答案>>
由于碘在海水中含量太低,目前还不能直接从海水中提取碘。海带有吸附碘离子特殊的能力,它们能把海水中的碘富集到是海水中的l0万倍以上,经测定:1000g某海带样品中含有6.35g碘离子。从海带中提取单质碘的实验步骤如下

(1)步骤②的实验操作除溶解外,还有___________________。
(2)若使用氯气做氧化剂,步骤③中发生反应的离子方程式为__________________________;为检验所生成的碘单质,选用的试剂是__________________。
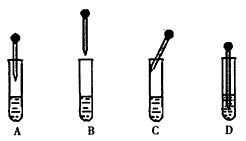
(3)步骤④中从含碘单质的有机溶液中分离出单质碘和回收有机溶剂,应选择的实验装置是__________
(2)若使用氯气做氧化剂,步骤③中发生反应的离子方程式为__________________________;为检验所生成的碘单质,选用的试剂是__________________。
(3)步骤④中从含碘单质的有机溶液中分离出单质碘和回收有机溶剂,应选择的实验装置是__________

(4)若将l000g上述海带中的碘离子全部氧化,至少需要通入标准状况下的氯气的体积为______________
查看习题详情和答案>>
氢、氮、氧三种元素可以分别两两组成如氮氧化物、氮氢化物和氢氧化物等,科学家们已经研究和利用其特殊性质开发其特有的功能.
(1)肼(N2H4)的制备方法之一是将NaClO溶液和NH3反应制得,试写出该反应的化学方程式
(2)肼可作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.
N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ?mol-1 N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ?mol-1
写出肼和NO2反应的热化学方程式:
(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液,反应生成N2和水蒸气.该电池放电时,负极的电极反应式为
(4)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图1、图2所示
注:以上实验均在温度为20℃、w(H2O2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg?L-1的条件下进行.图中曲线a:H2O2;b:H2O2+Cu2+; c:H2O2+Fe2+; d:H2O2+Zn2+;e:H2O2+Mn2+;图10中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关).
由上述信息可知,下列叙述错误的是
A.锰离子能使该降解反应速率减缓
B.亚铁离子对该降解反应的催化效率比铜离子低
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小.
查看习题详情和答案>>
(1)肼(N2H4)的制备方法之一是将NaClO溶液和NH3反应制得,试写出该反应的化学方程式
NaClO+2NH3=N2H4+NaCl+H2O
NaClO+2NH3=N2H4+NaCl+H2O
.(2)肼可作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.
N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ?mol-1 N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ?mol-1
写出肼和NO2反应的热化学方程式:
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7kJ?mol-1;
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7kJ?mol-1;
.(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液,反应生成N2和水蒸气.该电池放电时,负极的电极反应式为
N2H4+4OH--4e-=N2+4H2O
N2H4+4OH--4e-=N2+4H2O
.(4)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图1、图2所示

注:以上实验均在温度为20℃、w(H2O2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg?L-1的条件下进行.图中曲线a:H2O2;b:H2O2+Cu2+; c:H2O2+Fe2+; d:H2O2+Zn2+;e:H2O2+Mn2+;图10中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关).
由上述信息可知,下列叙述错误的是
B
B
(填序号).A.锰离子能使该降解反应速率减缓
B.亚铁离子对该降解反应的催化效率比铜离子低
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小.