网址:http://m.1010jiajiao.com/timu3_id_8008[举报]
(1)先写元素符号(正前负后)
(2)标出各元素的化合价(正上方)
(3)把化合价数值化为最简
(4)把化简后的数字交叉写出(求最小公倍数)
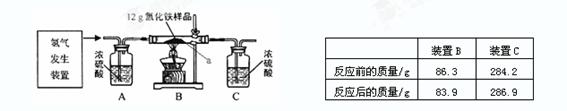
 某同学为测定12g含杂质的氧化铁样品中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了如图所示的装置,进行有关的实验探究(提示:氢气和氧化铁在高温条件下发生置换反应,杂质不参加反应,浓硫酸具有吸水性,假定每步均完全反应或吸收).
某同学为测定12g含杂质的氧化铁样品中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了如图所示的装置,进行有关的实验探究(提示:氢气和氧化铁在高温条件下发生置换反应,杂质不参加反应,浓硫酸具有吸水性,假定每步均完全反应或吸收).主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;
②缓缓通入干燥的氢气; ③点燃B处酒精灯; ④反应结束熄灭B处酒精灯;
⑤待装置B冷却至室温再停止通氢气; ⑥再次称量必要装置的质量.
| 装置B | 装置C | |
| 反应前的质量/g | 86.3 | 286.9 |
| 反应后的质量/g | 83.9 | 284.2 |
(2)实验时先通氢气后加热的目的是
(3)装置B处的现象
(4)实验结束为什么先停止加热,待装置B冷却至室温再停止通氢气
(5)请计算样品中氧化铁的质量分数.(写出计算步骤,计算结果精确到0.l%)
(6)该实验还可测定组成水的各元素之间的质量关系,请用表中实验数据列式表示出水中氢、氧元素的质量比为
某同学为测定12g含杂质的氧化铁样品中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了下图所示的装置,进行有关的实验探究(提示:氢气和氧化铁在高温条件下发生置换反应,杂质不参加反应,浓硫酸具有吸水性,假定每步均完全反应或吸收)。
主要实验步骤如 下:
下:
①按顺序组装仪器,检查装置的气密性,称量样品和必 要装置的质量;②缓缓通入干燥的氢气;③点燃B处酒精灯;④反应结束熄灭B处酒精灯;⑤待装置B冷却至室温再停止通氢气;⑥再次称量必要装置的质量。
要装置的质量;②缓缓通入干燥的氢气;③点燃B处酒精灯;④反应结束熄灭B处酒精灯;⑤待装置B冷却至室温再停止通氢气;⑥再次称量必要装置的质量。
(1)实验时先通氢气后加热的目的是 。验证该步骤目的达到的实验方法是 。
(2)装置B处的现象 发生反应的化学方程式
(3)请计算样品中氧化铁的质量分数
(4)该实验还可测定组成水的各元素之间的质量关系,请用表中实验数据列式表示出水中氢、氧元素的质量比为 (不用化简);若氧化铁没有完全反应,则求得水中氢、氧元素的质量比会 (“偏大” 、“偏小”或“不变”);若缺少装置A,则求得水中氢、氧元素的质量比会 (“偏大”、“偏小”或“不变”)
、“偏小”或“不变”);若缺少装置A,则求得水中氢、氧元素的质量比会 (“偏大”、“偏小”或“不变”)
某同学为测定12g含杂质的氧化铁样品中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了下图所示的装置,进行有关的实验探究(提示:氢气和氧化铁在高温条件下发生置换反应,杂质不参加反应,浓硫酸具有吸水性,假定每步均完全反应或吸收)。
主要实验步骤如 下:
下:
①按顺序组装仪器,检查装置的气密性,称量样品和必 要装置的质量;②缓缓通入干燥的氢气;③点燃B处酒精灯;④反应结束熄灭B处酒精灯;⑤待装置B冷却至室温再停止通氢气;⑥再次称量必要装置的质量。
要装置的质量;②缓缓通入干燥的氢气;③点燃B处酒精灯;④反应结束熄灭B处酒精灯;⑤待装置B冷却至室温再停止通氢气;⑥再次称量必要装置的质量。
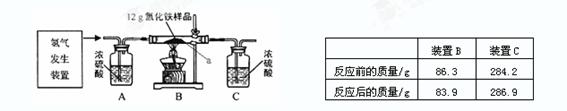
(1)实验时先通氢气后加热的目的是 。验证该步骤目的达到的实验方法是 。
(2)装置B处的现象 发生反应的化学方程式
(3)请计算样品中氧化铁的质量分数
(4)该实验还可测定组成水的各元素之间的质量关系,请用表中实验数据列式表示出水中氢、氧元素的质量比为 (不用化简);若氧化铁没有完全反应,则求得水中氢、氧元素的质量比会 (“偏大” 、“偏小”或“不变”);若缺少装置A,则求得水中氢、氧元素的质量比会 (“偏大”、“偏小”或“不变”)
、“偏小”或“不变”);若缺少装置A,则求得水中氢、氧元素的质量比会 (“偏大”、“偏小”或“不变”)
【查阅资料】
资料一:Fe粉和Fe3O4粉末能被磁铁吸引而FeO(黑色)不能;
资料二:Fe3O4中铁元素有+2、+3两种化合价,其化学式可用FeO?Fe2O3 的形式表示;
【提出猜想】黑色物质可能是Fe3O4、FeO和Fe粉中的一种或几种.
【进行实验】兴趣小组收集了CO与Fe2O3反应生成的黑色物质进行了下列实验:
| 实验方案 | 实验现象 | |
| 甲 | 取少量黑色物质用磁铁吸引 | 黑色物质全部被磁铁吸引 |
| 乙 | 取少量黑色物质加入30%热的盐酸中 | 无气泡、溶液颜色变成黄绿色 |
| 丙 | 取少量黑色物质加入硫酸铜溶液中 | 无任何现象 |
(1)甲实验现象说明黑色物质中没有
(2)生成的黑色物质应为Fe3O4;
(3)写出黑色粉末和热的盐酸反应的化学方程式
【拓展探究】同学们对Fe3O4产生了兴趣,从参考资料中找到了氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图.
【生产流程】
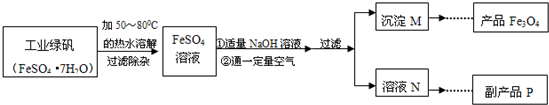
【查阅资料】
资料一:硫酸亚铁在不同温度下的溶解度如下表所示:
| 温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
资料三:获得Fe3O4的反应原理为:Fe(OH)2+2Fe(OH)3
| ||
【问题讨论】
(1)溶解时,用50℃至80℃的热水目的是
(2)写出加入适量NaOH溶液时发生反应的化学方程式
(3)上述过程中,要控制“通一定量空气”的目的是
(4)要使四氧化三铁的产率最高,则上述流程中产生的Fe(OH)2和Fe(OH)3的最佳质量比为
(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→
a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水
【组成确定】为确定用以上方法制得的四氧化三铁中可能含有的杂质,同学们又进行了下列实验探究.
【查阅资料】
资料一:难溶性碱受热时能分解产生金属氧化物和水(反应中各种元素的化合价不变);
资料二:Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe;
【提出猜想】Fe3O4中可能含有的杂质是Fe2O3和FeO中的一种或两种.
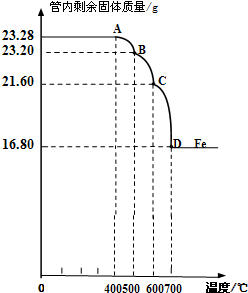
【实验设计】同学们称取了23.28g该Fe3O4样品进行了下列实验:
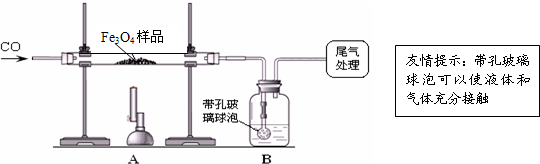
【实验分析】因探究思路不同,兴趣小组分成甲、乙两小组.
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该Fe3O4样品中的杂质.B中的最佳试剂是_
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,CO气体除作为反应物外,还能起到的作用是:①实验开始时,排尽装置中的空气,防止加热时发生爆炸;②停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;③
(3)乙组同学认为B装置反应前后的
 质量差会偏小而影响计算、分析,你认为他们的理由是
质量差会偏小而影响计算、分析,你认为他们的理由是乙组:
利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(右图).
(1)写出BC段发生反应的化学方程式:
| ||
| ||
(2)通过计算确定:该Fe3O4样品中含有的杂质是