摘要:[设计与实施方案](1)取步骤③所得的溶液少许.于一支洁净试管中.滴加KSCN溶液.如溶液不显血红色.再向溶液中滴加少量氯水.溶液显血红色.证明原溶液中只含有Fe2+ (2)过量 防止未反应的铁与硫酸反应.生成亚铁离子干扰实验 (3)防止氧气参与反应 (4)铁和硫的反应是放热反应 (5) 除去过量的硫粉 3S+6OH-2S2-+SO+3H2O (6)③ 为了防止溶液中的氧气氧化亚铁离子 在滤渣中加入煮沸的稀H2SO418.在通常状况下.A为固态单质.根据下图转化关系.回答: (1)写出A.C.E的化学式: A .C .E . (2)写出下列反应的化学方程式: ①E―→C , ②C―→D . (3)B与D的浓溶液 发生反应.若能反应.则反应的化学方程式为 .反应现象为 . (4)将C通入BaCl2溶液中.没有明显现象.但若加入H2O2.则有白色沉淀生成.请分析其原因 .并写出有关的化学方程式 . 思路分析:以ACDE为解题突破口.A为固态单质.B为A元素的氢化物.C为A元素的氧化物.再结合图示中的各转化关系做出推断. 解析:因A为固态单质.则B为其氢化物.C为其氧化物.故A为固态非金属单质.由ACDE.知E为能与Cu反应的酸(浓H2SO4或HNO3).由A为固态单质.推断A为S.B为H2S.C为SO2.D为SO3.E为H2SO4.D的浓溶液即浓H2SO4.与H2S易发生氧化还原反应.可生成单质S和SO2使溶液变浑浊.产生有刺激性气味的气体.H2O2有强氧化性.根据题意能把+4价硫(SO2)氧化为+6价硫(H2SO4).按要求写出相关化学方程式即可. 答案:(1)S SO2 H2SO4 (2)①Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O ②2SO2+O22SO3 (3)能 H2S+H2SO4(浓)===S↓+SO2↑+2H2O 溶液变浑浊.有刺激性气味的气体放出 (4)H2O2具有强氧化性.能把SO2氧化为H2SO4 H2O2+SO2===H2SO4,H2SO4+BaCl2===BaSO4↓+2HCl
网址:http://m.1010jiajiao.com/timu3_id_80054[举报]
探究性问题在理论指导元素化合物实验具有重要意义。
[问题] 对于已达平衡的可逆反应,当其它条件不变时,改变反应物或生成物的浓度会对化学平衡有何影响?
[猜想与假设]
假设1:化学反应处于平衡状态时,其它条件不变,增加反应物浓度,使平衡向正反应方向移动。
假设2:化学反应处于平衡状态时,其它条件不变,增加反应物浓度,使平衡向逆反应方向移动。
假设3:化学反应处于平衡状态时,其它条件不变,增加生成物浓度,使平衡向逆反应方向移动。
假设4:化学反应处于平衡状态时,其它条件不变,增加生成物浓度,使平衡向正反应方向移动。
[设计和实施方案] 在已反应平衡的FeCl3和KSCN的混合液中,分别加入:①FeCl3溶液 ②KSCN溶液 ③KCl固体 ④NaF溶液实验用品:仪器:烧杯、玻璃棒、胶头滴管试剂:FeCl3(aq)(0.01 mol/L,1.0 mol/L),KSCN(aq)(0.01 mol/L,1.0 mol/L),KCl(s), NaF(aq)(1.0 mol/L)。
实验步骤:
1.往250 mL烧杯中加入100 mL蒸馏水,然后加入10 mL 0.01 mol/L FeCl3溶液,再加入10 mL 0.01 mol/L KSCN溶液,溶液由黄色变成橙红色。
2.取5支试管,编号分别为1,2,3,4,5,然后各取步骤(1)中FeCl3和KSCN的混合溶液4 Ml加到5支试管中。往1号试管滴加2~3滴1.0 mol/L FeCl3溶液,振荡,观察现象;往2号试管滴加2~3滴1.0 mol/L KSCN溶液,振荡,观察现象;往3号试管中加入少量KCl固体,振荡,观察现象;往4号试管中滴加2~3滴1.0 mol/L NaF溶液,振荡,观察现象。
(1)根据你所学的内容完成下列表格,并回答有关问题。FeCl3与KSCN溶液反应
[问题] 对于已达平衡的可逆反应,当其它条件不变时,改变反应物或生成物的浓度会对化学平衡有何影响?
[猜想与假设]
假设1:化学反应处于平衡状态时,其它条件不变,增加反应物浓度,使平衡向正反应方向移动。
假设2:化学反应处于平衡状态时,其它条件不变,增加反应物浓度,使平衡向逆反应方向移动。
假设3:化学反应处于平衡状态时,其它条件不变,增加生成物浓度,使平衡向逆反应方向移动。
假设4:化学反应处于平衡状态时,其它条件不变,增加生成物浓度,使平衡向正反应方向移动。
[设计和实施方案] 在已反应平衡的FeCl3和KSCN的混合液中,分别加入:①FeCl3溶液 ②KSCN溶液 ③KCl固体 ④NaF溶液实验用品:仪器:烧杯、玻璃棒、胶头滴管试剂:FeCl3(aq)(0.01 mol/L,1.0 mol/L),KSCN(aq)(0.01 mol/L,1.0 mol/L),KCl(s), NaF(aq)(1.0 mol/L)。
实验步骤:
1.往250 mL烧杯中加入100 mL蒸馏水,然后加入10 mL 0.01 mol/L FeCl3溶液,再加入10 mL 0.01 mol/L KSCN溶液,溶液由黄色变成橙红色。
2.取5支试管,编号分别为1,2,3,4,5,然后各取步骤(1)中FeCl3和KSCN的混合溶液4 Ml加到5支试管中。往1号试管滴加2~3滴1.0 mol/L FeCl3溶液,振荡,观察现象;往2号试管滴加2~3滴1.0 mol/L KSCN溶液,振荡,观察现象;往3号试管中加入少量KCl固体,振荡,观察现象;往4号试管中滴加2~3滴1.0 mol/L NaF溶液,振荡,观察现象。
(1)根据你所学的内容完成下列表格,并回答有关问题。FeCl3与KSCN溶液反应
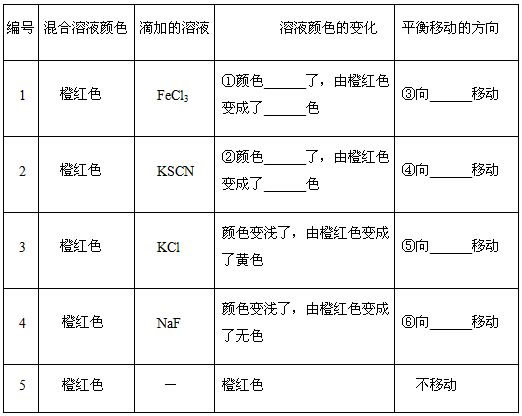
(2)由①②现象说明假设______成立,假设______不成立。
(3)根据Fe3++3SCN-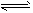 Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是_____________________。
Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是_____________________。
(4)根据“4”号试管中的现象,分析在4号试管中发生的变化是____________,说明了 __________(从改变浓度影响平衡移动角度回答)
查看习题详情和答案>>
(3)根据Fe3++3SCN-
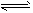 Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是_____________________。
Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是_____________________。 (4)根据“4”号试管中的现象,分析在4号试管中发生的变化是____________,说明了 __________(从改变浓度影响平衡移动角度回答)
(2009?静安区二模)白铁即镀锌铁皮,某学习小组的三位同学为了测定锌镀层的厚度,提出了各自的设计方案.
Ⅰ.甲同学的方案是,先用盐酸将镀锌铁皮表面的锌反应掉,通过差量算出锌的质量,然后再由查得的锌密度算出锌层的体积,最后由体积除以镀锌铁皮面积算得锌层厚度.
(1)配制1mol/L的盐酸100mL,需取用36.5%(ρ=1.181g/cm3)的盐酸
(2)将相同大小相同厚度的普通锌片和镀锌铁皮放入两只试管,各加入同量1mol/L的盐酸,观察镀锌铁皮比普通锌片与盐酸反应速率更快,产生此现象的原因是
(3)判断镀锌铁皮表面锌恰好反应的现象是
Ⅱ.乙同学的意见及方案.
(1)意见:因为难以避免铁也会反应,所以甲同学测出锌的厚度会
(2)方案:通过查阅资料,知道Zn(OH)2既可以和酸反应又可以和碱反应,于是设计了如下方案:

步骤③的操作是
Ⅲ.丙同学查得Fe(OH)2、Zn(OH)2开始沉淀的pH分别为6.5和5.6,认为也可用容量法(即滴定法)检测且准确度更高.该方法的要点是:准确称取m g白铁,加入过量c mol/L的盐酸bml,再用标准NaOH溶液滴定过量的盐酸,为了防止生成沉淀,应选用的指示剂是
a.酚酞 b.石蕊 c.甲基橙.
查看习题详情和答案>>
Ⅰ.甲同学的方案是,先用盐酸将镀锌铁皮表面的锌反应掉,通过差量算出锌的质量,然后再由查得的锌密度算出锌层的体积,最后由体积除以镀锌铁皮面积算得锌层厚度.
(1)配制1mol/L的盐酸100mL,需取用36.5%(ρ=1.181g/cm3)的盐酸
8.5
8.5
mL;配制过程中要用到的玻璃仪器除量筒、烧杯、玻璃棒外,还有100mL容量瓶、胶头滴管
100mL容量瓶、胶头滴管
.(2)将相同大小相同厚度的普通锌片和镀锌铁皮放入两只试管,各加入同量1mol/L的盐酸,观察镀锌铁皮比普通锌片与盐酸反应速率更快,产生此现象的原因是
镀锌铁皮发生了原电池反应
镀锌铁皮发生了原电池反应
;在翻动横放在烧杯中镀锌铁皮时,发现溶液上方的锌层变薄的速率比下方的锌层快得多,其原因可能是下方的气泡阻止了酸液与锌层的接触
下方的气泡阻止了酸液与锌层的接触
.(3)判断镀锌铁皮表面锌恰好反应的现象是
产生气泡的速率明显下降
产生气泡的速率明显下降
.Ⅱ.乙同学的意见及方案.
(1)意见:因为难以避免铁也会反应,所以甲同学测出锌的厚度会
偏大
偏大
(选填偏大或偏小).(2)方案:通过查阅资料,知道Zn(OH)2既可以和酸反应又可以和碱反应,于是设计了如下方案:

步骤③的操作是
过滤、洗涤
过滤、洗涤
;若使用的镀锌铁片的质量为28.156g,最后称得灼烧后固体的质量为40.000g,镀锌铁片的长5.10cm,宽5.00cm,锌的密度ρ=7.14g/cm3,则锌镀层的厚度为4.30×10-4
4.30×10-4
cm.Ⅲ.丙同学查得Fe(OH)2、Zn(OH)2开始沉淀的pH分别为6.5和5.6,认为也可用容量法(即滴定法)检测且准确度更高.该方法的要点是:准确称取m g白铁,加入过量c mol/L的盐酸bml,再用标准NaOH溶液滴定过量的盐酸,为了防止生成沉淀,应选用的指示剂是
c
c
(选填序号).a.酚酞 b.石蕊 c.甲基橙.
如何利用实验室常见的药品试剂探究11号~17号元素的金属性逐渐减弱,非金属性逐渐增强?已知实验室有你想用到的仪器和药品、试纸等一切用品.
猜想与假设:(1)用
(2)因实验室不可能有硅单质,但可以测0.1mol/L的
(3)制取饱和的氯水和饱和的氢硫酸溶液,用将
设计和实施方案:(1)用列表的方式(从实验方案、实验现象、有关化学方程式)完成你的实验报告中的实验内容.
(2)实验结论是
(3)请你用物质结构理论知识解释结论.
查看习题详情和答案>>
猜想与假设:(1)用
钠、镁、铝
钠、镁、铝
三种金属分别与水反应,通过观察生成气泡的速率便会得出从钠
钠
到铝
铝
金属性逐渐减弱.(2)因实验室不可能有硅单质,但可以测0.1mol/L的
Na2SiO3
Na2SiO3
溶液和Na3PO4
Na3PO4
溶液及Na2SO4溶液的pH,推断三种盐溶液的水解情况,得出H2SiO3
H2SiO3
、H3PO4
H3PO4
、硫酸三种最高价含氧酸的酸性强弱顺序是H2SiO3<H3PO4<H2SO4
H2SiO3<H3PO4<H2SO4
,从而得出从Si
Si
到S
S
非金属性逐渐增强.(3)制取饱和的氯水和饱和的氢硫酸溶液,用将
饱和氯水滴加到饱和氢硫酸溶液中的
饱和氯水滴加到饱和氢硫酸溶液中的
方法,通过溶液中有浅黄色沉淀生成
溶液中有浅黄色沉淀生成
现象便直接得出非金属性S比Cl弱.设计和实施方案:(1)用列表的方式(从实验方案、实验现象、有关化学方程式)完成你的实验报告中的实验内容.
(2)实验结论是
金属性:Na>Mg>Al,非金属性:Si<P<S<Cl
金属性:Na>Mg>Al,非金属性:Si<P<S<Cl
.(3)请你用物质结构理论知识解释结论.
如何利用实验室常见的药品试剂探究11号~17号元素的金属性逐渐减弱,非金属性逐渐增强?已知实验室有你想用到的仪器和药品、试纸等一切用品.
猜想与假设:(1)用______三种金属分别与水反应,通过观察生成气泡的速率便会得出从______到______金属性逐渐减弱.
(2)因实验室不可能有硅单质,但可以测0.1mol/L的______溶液和______溶液及Na2SO4溶液的pH,推断三种盐溶液的水解情况,得出______、______、硫酸三种最高价含氧酸的酸性强弱顺序是______,从而得出从______到______非金属性逐渐增强.
(3)制取饱和的氯水和饱和的氢硫酸溶液,用将______方法,通过______现象便直接得出非金属性S比Cl弱.
设计和实施方案:(1)用列表的方式(从实验方案、实验现象、有关化学方程式)完成你的实验报告中的实验内容.
(2)实验结论是______.
(3)请你用物质结构理论知识解释结论.
查看习题详情和答案>>
猜想与假设:(1)用______三种金属分别与水反应,通过观察生成气泡的速率便会得出从______到______金属性逐渐减弱.
(2)因实验室不可能有硅单质,但可以测0.1mol/L的______溶液和______溶液及Na2SO4溶液的pH,推断三种盐溶液的水解情况,得出______、______、硫酸三种最高价含氧酸的酸性强弱顺序是______,从而得出从______到______非金属性逐渐增强.
(3)制取饱和的氯水和饱和的氢硫酸溶液,用将______方法,通过______现象便直接得出非金属性S比Cl弱.
设计和实施方案:(1)用列表的方式(从实验方案、实验现象、有关化学方程式)完成你的实验报告中的实验内容.
(2)实验结论是______.
(3)请你用物质结构理论知识解释结论.
查看习题详情和答案>>
如何利用实验室常见的药品试剂探究11号~17号元素的金属性逐渐减弱,非金属性逐渐增强?已知实验室有你想用到的仪器和药品、试纸等一切用品.
猜想与假设:(1)用______三种金属分别与水反应,通过观察生成气泡的速率便会得出从______到______金属性逐渐减弱.
(2)因实验室不可能有硅单质,但可以测0.1mol/L的______溶液和______溶液及Na2SO4溶液的pH,推断三种盐溶液的水解情况,得出______、______、硫酸三种最高价含氧酸的酸性强弱顺序是______,从而得出从______到______非金属性逐渐增强.
(3)制取饱和的氯水和饱和的氢硫酸溶液,用将______方法,通过______现象便直接得出非金属性S比Cl弱.
设计和实施方案:(1)用列表的方式(从实验方案、实验现象、有关化学方程式)完成你的实验报告中的实验内容.
(2)实验结论是______.
(3)请你用物质结构理论知识解释结论.
查看习题详情和答案>>
猜想与假设:(1)用______三种金属分别与水反应,通过观察生成气泡的速率便会得出从______到______金属性逐渐减弱.
(2)因实验室不可能有硅单质,但可以测0.1mol/L的______溶液和______溶液及Na2SO4溶液的pH,推断三种盐溶液的水解情况,得出______、______、硫酸三种最高价含氧酸的酸性强弱顺序是______,从而得出从______到______非金属性逐渐增强.
(3)制取饱和的氯水和饱和的氢硫酸溶液,用将______方法,通过______现象便直接得出非金属性S比Cl弱.
设计和实施方案:(1)用列表的方式(从实验方案、实验现象、有关化学方程式)完成你的实验报告中的实验内容.
(2)实验结论是______.
(3)请你用物质结构理论知识解释结论.