网址:http://m.1010jiajiao.com/timu3_id_79487[举报]
(2)温度:水的电离是
雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是 。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示: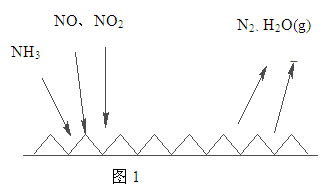
①由图1可知SCR技术中的氧化剂为 。
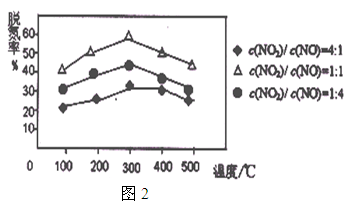
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图2所示,脱氮效果最佳的c(NO2)/c(NO)= 。当NO2与NO的物质的量之比为1:1时,用氨脱氮,每生成1molN2放出的热量为QkJ,写出该反应的热化学方程式 。
(3)海水具有良好的吸收SO2的能力,其吸收过程如下:
①SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32-,SO32-可以被海水中的溶解氧氧化为SO42-。海水的pH会 (填“升高” 、“不变”或“降低”)。
②SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是 。
(4)碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可将SO2通入TeCl4的酸性溶液中进行“还原”得到碲,该反应的化学方程式是_________ 。
(1)氮、氧元素非金属性较强的是 。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:


①由图1可知SCR技术中的氧化剂为 。
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图2所示,脱氮效果最佳的c(NO2)/c(NO)= 。当NO2与NO的物质的量之比为1:1时,用氨脱氮,每生成1molN2放出的热量为QkJ,写出该反应的热化学方程式 。
(3)海水具有良好的吸收SO2的能力,其吸收过程如下:
①SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32-,SO32-可以被海水中的溶解氧氧化为SO42-。海水的pH会 (填“升高” 、“不变”或“降低”)。
②SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是 。
(4)碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可将SO2通入TeCl4的酸性溶液中进行“还原”得到碲,该反应的化学方程式是_________ 。
汞(Hg)、铬(Cr)是影响环境污染、生物效应和人类健康的重金属元素。
I、铬广泛应用于钢铁工业、磁带和录像带等方面。
(1)工业常采用“铝在高温条件下还原铬绿(Cr2O3)”制备铬单质,该反应的化学方程式为 。
II、含铬的工业废水会导致慢性中毒。处理含+6价铬的废水时可得到铁氧体(其组成可写作[Fe2+Fe3+(2-x) Cr3+x]O4)。

(2)加过量FeSO4的目的是 。
(3)配平步骤①的反应的离子方程式 Fe2++ Cr2O72—+ _____== Fe3++ Cr3++ H2O
并计算铁氧体( [Fe2+Fe3+(2-x) Cr3+x]O4)中X= _________________。
(4)下表是实验检测中心对某地区二个点的土壤样品(每个点分三层取样,共6个样品)进行了有机质和铬总量的测定,结果见下表。
|
样品序号 |
取样深度(m) |
有机质(×10—2g) |
总铬(×10—6g) |
|
样品A-1 |
0.00 ~ 0.30 |
2.81 |
114 |
|
样品A-2 |
0.30 ~ 0.60 |
1.72 |
111 |
|
样品A-3 |
1.20 ~ 1.80 |
1.00 |
88 |
|
样品B-1 |
0.00 ~ 0.30 |
2.60 |
116 |
|
样品B-2 |
0.30 ~ 0.60 |
2.48 |
112 |
|
样品B-3 |
1.20 ~ 1.80 |
1.83 |
106 |
从表中你可以得出的结论有 (答一点即可)。
(5)工业上以铬酸钾(K2CrO4)为原料,电化学法制备重铬酸钾,装置如图。反应为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+
2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为
。原因是
。
Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为
。原因是
。

查看习题详情和答案>>