网址:http://m.1010jiajiao.com/timu3_id_79443[举报]
试回答下列问题:
(1)上述溶液中有水解反应发生的是______(填编号,下同),溶液中溶质存在电离平衡的是______;
(2)比较①、②溶液,pH值较大的是______;
(3)在溶液④中加入少量NH4Cl固体,此时C(NH4+)/C(OH-)的值将______(填“变小”、“变大”或“不变”);
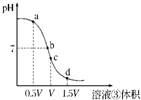
(4)用溶液③滴定V mL溶液④其滴定曲线如图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点,水的电离程度最大的是______点,理由是______;
②a点溶液中离子浓度大小关系是______;
③取少量c点溶液于试管,再滴加0.1mol/L NaOH溶液至中性.此时溶液中除H+、OH-外,离子浓度大小关系是______.
试回答下列问题:
(1)上述溶液中有水解反应发生的是__________(填编号,下同), 溶液中溶质存在电离平衡的是
____________________;
(2)比较①、②溶液,PH值较大的是____________________;
(3)在溶液④中加入少量NH4Cl固体,此时
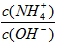 的值将_________(填“变小”,“变大”或“不变”);
的值将_________(填“变小”,“变大”或“不变”); (4)用溶液③滴定V mL溶液④,其滴定曲线如图所示
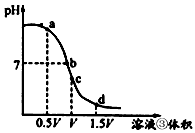
②取少量c点溶液于试管,再滴加0.1 mol/L NaOH溶液至中性。此时溶液中除H+、OH-外,其它离子浓度由大到小的顺序是________________________。
试回答下列问题:
(1)上述溶液中有水解反应发生的是______(填编号,下同),溶液中溶质存在电离平衡的是______;
(2)比较①、②溶液,pH值较大的是______;
(3)在溶液④中加入少量NH4Cl固体,此时C(NH4+)/C(OH-)的值将______(填“变小”、“变大”或“不变”);
(4)用溶液③滴定V mL溶液④其滴定曲线如图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点,水的电离程度最大的是______点,理由是______;
②a点溶液中离子浓度大小关系是______;
③取少量c点溶液于试管,再滴加0.1mol/L NaOH溶液至中性.此时溶液中除H+、OH-外,离子浓度大小关系是______.
 查看习题详情和答案>>
查看习题详情和答案>>
(A类)常温下,浓度均为0.1 mol·L-1的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 ;
(2)比较①、②溶液,PH值较大的是 ;
(3)在溶液④中加入少量NH4Cl固体,此时![]() 的值
的值
将 (填“变小”,“变大”或“不变”);
(4)用溶液③滴定V mL溶液④,其滴定曲线如下图所示:

①试分析在滴定过程中,滴定曲线上a、b、c、d四点:
水的电离程度最大的是 点;
②取少量c点溶液于试管,再滴加0.1 mol/L NaOH溶液至中性。此时溶液中除H+、OH-外,其它离子浓度由大到小的顺序是 。
查看习题详情和答案>>(18分)实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图:
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为 。
(2)在上述实验方案中有一明显欠缺,该欠缺是 。
(3)在欠缺已经改正的方案下,反应起始时,产生氢气的速率关系应是 ;最终产生氢气的体积关系应是 。
(4)实验中产生的氢气体积比理论值高,可能原因是 。
(5)通过比较起始反应的速率可以得出的结论是 。
(6)除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中一种更简单的方法
。
实验二:某二元酸(H2B)在水中的电离方程式是: H2B=H++HB- HB- H++B2-
回答下列问题:
(1)请判断H2B是强电解质还是弱电解质?
(2)已知0.1mol·L-1 NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度应 0.11 mol·L-1(填“<”,“>”或“=”)
(3)在0.1mol/L的Na2B溶液中,下列离子浓度关系式正确的是_______。
A.c(H+)+c(HB-)+c(H2B)=0.1mol/L B.c(Na+)+c(OH-)=c(H+)+ c(HB-)
C.c(Na+)+ c(H+)=c(OH-)+ c(HB-)+2c(B2-) D.c(Na+)=2c(B2-)+2 c(HB-)
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是_______________________。
查看习题详情和答案>>