摘要:0.5 mol•L-1一元弱酸A和未知浓度的一元强碱B以1:2体积比混合.所得溶液的 [OH-]=0.1 mol•L-1.用B中和20mL一元弱酸C(该酸溶液[H+]= 0.01 mol•L-1).当恰好完全反应时.用去5mLB溶液.求弱酸C的电离度
网址:http://m.1010jiajiao.com/timu3_id_79439[举报]
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业制备无水AlCl3的流程如下

(1)已知:
C(s)+1/2O2(g)==CO(g) △H=-110.5kJ/mol
2Fe(s)+3/2O2(g)===Fe2O3(s) △H=-822.1kJ/mol
请写出C还原Fe2O3生成CO的热化学方程式___________________________。
(2)反应2CO+O2 2CO2的平衡常数为K1;反应4Fe+3O2
2CO2的平衡常数为K1;反应4Fe+3O2 2Fe2O3的平衡常数K2,则反应
2Fe2O3的平衡常数K2,则反应
3CO+Fe2O3 2Fe+3CO2的平衡常数K与K1、K2的关系式___________。
2Fe+3CO2的平衡常数K与K1、K2的关系式___________。
(3)高温下,氧化铁能跟碳发生下列反应:
① Fe2O3+3C 2Fe+3CO ② Fe2O3+3CO
2Fe+3CO ② Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
若反应产生的气体是CO2和CO,则 的取值范围是_________________。
的取值范围是_________________。
(4)氯化炉中生成的气体,通常用碱性的亚硫酸钠溶液来吸收,请用离子方程式分析亚硫酸钠溶液呈碱性的原因____________________。
(5)氯化炉中发生:3Cl2(g)+3C(s)+Al2O3(s) 2AlCl3(g)+3CO(g) △H>0,欲提高金属铝的氯化效果,不可采取的措施是______(填序号):
2AlCl3(g)+3CO(g) △H>0,欲提高金属铝的氯化效果,不可采取的措施是______(填序号):
①增加C的量 ②多通入Cl2 ③升高温度 ④移走部分AlCl3(g)
⑤使用合适的催化剂工业上还常采用向氯化炉中通入O2的方法,其目的是________________。
(6)沉淀分析法一般规定:溶液中某离子物质的量浓度低于1.0×10-5 mol/L时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2mol/L。此时所得沉淀中_____(填“是”或“否”)含有Al(OH)3。(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33)。
查看习题详情和答案>>
C(s)+1/2O2(g)==CO(g) △H=-110.5kJ/mol
2Fe(s)+3/2O2(g)===Fe2O3(s) △H=-822.1kJ/mol
请写出C还原Fe2O3生成CO的热化学方程式___________________________。
(2)反应2CO+O2
 2CO2的平衡常数为K1;反应4Fe+3O2
2CO2的平衡常数为K1;反应4Fe+3O2 2Fe2O3的平衡常数K2,则反应
2Fe2O3的平衡常数K2,则反应3CO+Fe2O3
 2Fe+3CO2的平衡常数K与K1、K2的关系式___________。
2Fe+3CO2的平衡常数K与K1、K2的关系式___________。(3)高温下,氧化铁能跟碳发生下列反应:
① Fe2O3+3C
 2Fe+3CO ② Fe2O3+3CO
2Fe+3CO ② Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2 若反应产生的气体是CO2和CO,则
 的取值范围是_________________。
的取值范围是_________________。(4)氯化炉中生成的气体,通常用碱性的亚硫酸钠溶液来吸收,请用离子方程式分析亚硫酸钠溶液呈碱性的原因____________________。
(5)氯化炉中发生:3Cl2(g)+3C(s)+Al2O3(s)
 2AlCl3(g)+3CO(g) △H>0,欲提高金属铝的氯化效果,不可采取的措施是______(填序号):
2AlCl3(g)+3CO(g) △H>0,欲提高金属铝的氯化效果,不可采取的措施是______(填序号): ①增加C的量 ②多通入Cl2 ③升高温度 ④移走部分AlCl3(g)
⑤使用合适的催化剂工业上还常采用向氯化炉中通入O2的方法,其目的是________________。
(6)沉淀分析法一般规定:溶液中某离子物质的量浓度低于1.0×10-5 mol/L时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2mol/L。此时所得沉淀中_____(填“是”或“否”)含有Al(OH)3。(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33)。
摩尔盐[xFeSO4?y(NH4)2SO4?zH2O]是一种重要化工原料.其组成可通过下列实验测定:
①称取1.568 0g样品,准确配成100mL溶液A.
②量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.466 0g.
③再量取25.00mL溶液A,滴加适量稀硫酸,用0.020 0mol?L-1 KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00mL.
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(S
)≤1.0×10-5 mol?L-1,应保持溶液中c(Ba2+ )≥
(2)③中发生反应的离子方程式为
(3)通过计算确定样品的组成(必须写出计算过程).
查看习题详情和答案>>
①称取1.568 0g样品,准确配成100mL溶液A.
②量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.466 0g.
③再量取25.00mL溶液A,滴加适量稀硫酸,用0.020 0mol?L-1 KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00mL.
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(S
| O | 2- 4 |
1.1×10-5
1.1×10-5
mol?L-1.(2)③中发生反应的离子方程式为
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
,滴定终点的现象是滴入最后一滴KMnO4时,溶液由无色变为浅紫色,且半分钟内不变色
滴入最后一滴KMnO4时,溶液由无色变为浅紫色,且半分钟内不变色
.(3)通过计算确定样品的组成(必须写出计算过程).
一定温度下,测得某纯水的pH为6.5.试计算:
(1)此时水的离子积常数Kw=
(2)若在此纯水中加一定量Ba(OH)2固体,配制成5.0×10-5 mol?L-1的Ba(OH)2溶液,保持原温度,其溶液的pH=
(3)取上述Ba(OH)2溶液200mL,加入等体积的一定物质的量浓度的Na2SO4溶液,则产生沉淀所需Na2SO4溶液的最小浓度要
(4)氯气在295K、100Kpa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应.请估算该反应的平衡常数?(列式计算)
查看习题详情和答案>>
(1)此时水的离子积常数Kw=
10-13
10-13
.(2)若在此纯水中加一定量Ba(OH)2固体,配制成5.0×10-5 mol?L-1的Ba(OH)2溶液,保持原温度,其溶液的pH=
9
9
.(3)取上述Ba(OH)2溶液200mL,加入等体积的一定物质的量浓度的Na2SO4溶液,则产生沉淀所需Na2SO4溶液的最小浓度要
8.0×10-6
8.0×10-6
mol.L-1[Ksp(BaSO4)=1.0×10-10].(4)氯气在295K、100Kpa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应.请估算该反应的平衡常数?(列式计算)
Cl2(aq)+H2O(l)=H+(aq)+Cl-(aq)+HClO(aq)
起始:0.0900 0
转化:0.030.030.030.03
平衡:0.060.030.030.03
平衡常数K=
=
=4.5×10-4 ,
起始:0.0900 0
转化:0.030.030.030.03
平衡:0.060.030.030.03
平衡常数K=
| c(H+).c(Cl-).c(HClO) |
| C(Cl2) |
| 0.03×0.03×0.03 |
| 0.06 |
Cl2(aq)+H2O(l)=H+(aq)+Cl-(aq)+HClO(aq)
起始:0.0900 0
转化:0.030.030.030.03
平衡:0.060.030.030.03
平衡常数K=
=
=4.5×10-4 ,
.起始:0.0900 0
转化:0.030.030.030.03
平衡:0.060.030.030.03
平衡常数K=
| c(H+).c(Cl-).c(HClO) |
| C(Cl2) |
| 0.03×0.03×0.03 |
| 0.06 |
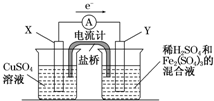 (2010?宝鸡一模)(2011?长春质检)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)
(2010?宝鸡一模)(2011?长春质检)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)(1)写出铜溶解于上述混合液的离子方程式
Cu+2Fe3+═Cu2++2Fe2+
Cu+2Fe3+═Cu2++2Fe2+
.(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是
0.64
0.64
g,溶液中的c(SO2- 4 |
0.5
0.5
mol/L.(3)若欲在如图所示的装置中发生(1)中的反应,请判断图中的正、负极,并选出适当的物质作电极,写出电极反应式,填在相应的表格中.
| 正、负极判断 | 电极材料 | 电极反应式 | |
| X极 | 负 负 |
铜 铜 |
Cu-2e-═Cu2+ Cu-2e-═Cu2+ |
| Y极 | 正 正 |
碳 碳 |
2Fe3++2e-═2Fe2+ 2Fe3++2e-═2Fe2+ |