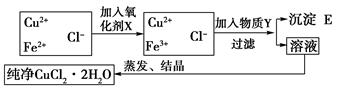
摘要:10.在氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质.为制得纯净的氯化铜晶体.首先将其溶于水后加少量盐酸配制成水溶液.然后按下图所示的操作步骤进行提纯. 已知Cu2+.Fe2+在pH=4-5时不水解.而Fe3+几乎完全水解而沉淀. (1)为什么要加入氧化剂? . (2)下列物质都可以作为氧化剂.其中最适合本实验的是 . A.H2O2 B.KMnO4 C.NaClO D.K2Cr2O7 (3)物质Y是 .加入Y的目的 .沉淀E是 . (4)欲将CuCl2·2H2O加热制得无水CuCl2.将采用什么方法和措施? . 解析:根据题意及框图可知.加入氧化剂的目的是将Fe2+氧化为Fe3+.为了不引入杂质.选用“绿色 氧化剂H2O2.其反应为:H2O2+2Fe2++2H+===2Fe3++2H2O.加入Y的目的是调节pH为4-5之间.升高pH.为了不引入杂质可选用CuO.Cu(OH)2或CuCO3或Cu2(OH)2CO3.沉淀是Fe(OH)3. 由于Cu2+易水解.为防止水解可将晶体CuCl2·2H2O在HCl气氛中加热. 答案:(1)将Fe2+氧化为Fe3+ 2或CuCO3或Cu2(OH)2CO3 调节pH.除去Fe3+ Fe(OH)3 (4)在HCl气氛下蒸发.以抑制CuCl2水解
网址:http://m.1010jiajiao.com/timu3_id_79293[举报]
氯化铜晶体
(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,然后按下图所示的操作步骤进行提纯:
又知
Fe2+、Fe3+、Cu2+从溶液中完全呈氢氧化物沉淀时的最小pH分别为Fe3+:3.7、Cu2+:6.4、Fe2+:9.6,试回答下列问题:(1)为了防止Cu2+水解,在实验开始时应先加入少许________.
(2)加入氧化剂的原因________,下列物质都可以作为氧化剂,其中最适宜于本实验的是________.
A.H2O2 B.KMnO4 C.NaClO D.K2Cr2O7
(3)加入的物质Y是________,其目的是________,沉淀Z是________.
在氯化铜(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下图所示的操作步骤进行提纯.已知在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀
(1)为什么加入氧化剂X?________________
(2)下列物质都可以作为氧化剂,其中最适合于本实验的是
A.H2O2 B.KMnO4 C.NaClO D.K2Cr2O7
(3)物质Y是 ;沉淀E是 。
查看习题详情和答案>>
在氯化铜(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下图所示的操作步骤进行提纯.已知在pH为4~5的环境中,Cu2+、Fe2+ 不生成沉淀,而Fe3+几乎完全沉淀
不生成沉淀,而Fe3+几乎完全沉淀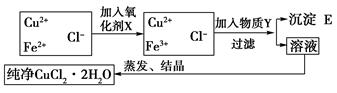
(1)为什么加入氧化剂X?________________
(2)下列物质都可以作为氧化剂,其中最适合于本实验的是
| A.H2O2 | B.KMnO4 | C.NaClO | D.K2Cr2O7 |
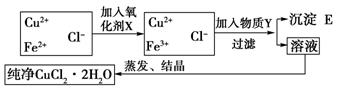
 不生成沉淀,而Fe3+几乎完全沉淀
不生成沉淀,而Fe3+几乎完全沉淀