摘要: Fenton法常用于处理含难降解有机物的工业废水.通常是在调节好 pH和Fe2+浓度的废水中加入H2O2.所产生的羟基自由基能氧化降解污染物.现运用该 方法降解有机污染物pCP.探究有关因素对该降解反应速率的影响. 实验设计 控制pCP的初始浓度相同.恒定实验温度在298 K或313 K.设计如下对比实验. (1)请完成以下实验设计表. 实验 编号 实验目的 T/K pH c/10-3 mol·L-1 H2O2 Fe2+ ① 为以下实验作参照 298 3 6.0 0.30 ② 探究温度对降解反应速率的影响 ③ 298 10 6.0 0.30 数据处理 实验测得pCP的浓度随时间变化的关系如上图. (2)请根据上图实验①曲线.计算降解反应50-150 s内的反应速率: v(pCP)= mol·L-1·s-1. 解释与结论 (3)实验①.②表明温度升高.降解反应速率增大.但温度过高时反而导致降解反应速率减小.请从Fenton法所用试剂H2O2的角度分析原因: . (4)实验③得出的结论是:pH等于10时. . 思考与交流 (5)实验时需在不同时间从反应器中取样.并使所取样品中的反应立即停止下来.根据上图中的信息.给出一种迅速停止反应的方法: . 解析:(1)由题意可知实验①是参照实验.所以与实验①相比.实验②和③只能改变一个条件.这样才能起到对比实验的目的.则实验②是探究温度对反应速率的影响.则T=313 K.pH=3.c(H2O2)=6.0 mol·L-1.c(Fe2+)=0.30 mol·L-1.实验③是探究pH的大小对反应速率的影响, (2)实验①曲线中.50-150 s内. Δc(pCP)=1.2×10-3 mol·L-1-0.4×10-3 mol·L-1=0.8×10-3 mol·L-1. 所以V(pCP)==8.0×10-6 mol·L-1·s-1. (3)在降解反应中.H2O2新产生的自由基起氧化作用.温度过高.H2O2因热稳定性差而分解.导致降解反应速率下降. (4)由双曲线③可知.pH=10时.c(pCP)基本不变.反应趋于停止. 得到启示:在pH=10溶液中.反应速率趋于零.可将所取样加入NaOH溶液中反应停止. 答案:(1) 实验 编号 实验目的 T/K pH c/10-3 mol·L-1 H2O2 Fe2+ ① ② 313 3 6.0 0.30 ③ 探究溶液的pH对降解反应速率的影响 (2)8.0×10-6 (3)过氧化氢在温度过高时迅速分解 (4)反应速率趋向于零 (5)将所取样品迅速加入到一定量的NaOH溶液中.使pH约为10(或将所取样品骤冷等其他合理答案均可)
网址:http://m.1010jiajiao.com/timu3_id_78587[举报]
谷氨酸一钠盐是味精的主要成分,谷氨酸一钠盐在水溶液中存在如下平衡:
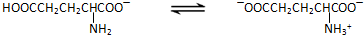
(1)当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖.实验室中检验淀粉水解产物可选用的试剂是______.
A.NaOH溶液、氨水、AgNO3溶液 B.H2SO4溶液、氨水、AgNO3溶液
C.NaOH溶液、CuSO4溶液 D.H2SO4溶液、CuSO4溶液
(2)“沙伦逊甲醛滴定法”可用于测定味精中谷氨酸一钠盐的含量.其方法如下:
将一定质量的味精样品溶于水,再向溶液中加入36%甲醛溶液,发生的反应如下:
R-NH2+HCHO→R-N=CH2+H2O(R表示除“-NH2”外的基团),再以酚酞为指示剂,用NaOH溶液进行滴定.
①上述测定过程中加入甲醛的目的是______.
②滴定终点的实验现象为______.
(3)味精中常含食盐,有两个同学分别设计甲、乙两种方案来测定味精中NaCl的含量.
①甲方案:取一定质量味精样品溶于水,加入足量稀硝酸酸化的硝酸银溶液,充分反应后,______(填写操作步骤),称量沉淀质量.
②乙方案:取mg味精溶于水,加入过量浓度为c1mol?L-1的AgNO3溶液,再加入少量______溶液做指示剂,用浓度为c2mol?L-1的NH4SCN溶液进行滴定,当溶液变为红色时,达到滴定终点.已知:AgSCN是难溶于水的沉淀.设测定过程中所消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1mL和V2mL,则该味精样品中NaCl的质量分数是______.
查看习题详情和答案>>
下列对有机物结构或性质的描述,错误的是( )
| A、一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | B、可以用铜丝燃烧法判断有机物中是否含有硫元素 | C、沸点:正丁烷>异丁烷>乙烷 | D、同位素示踪法可用于研究化学反应原理 |