网址:http://m.1010jiajiao.com/timu3_id_78455[举报]
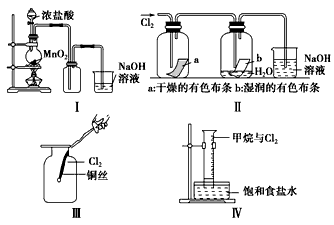
(2)Ⅱ图中退色的是A____(填“a”或“b”),Ⅱ图烧杯中发生反应的离子方程式是________________。
(3)将铜丝换成铁丝,做Ⅲ实验,结果也能点燃,你认为铁丝也能点燃的理由是A______(填选项字母)。
A.Fe与Cu都是金属元素 B.Fe的熔点比Cu高 C.Fe的密度比Cu小 D.Fe的金属性比Cu强
(4)将Ⅳ装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状液滴生成,饱和食盐水中有少量固体析出,量筒内黄绿色气体颜色变浅,量筒内液面上升等。
①油状液滴的成分可能是(写分子式) _____________。
②水槽用饱和食盐水而不用水的原因是__________________。
③饱和食盐水中有少量固体析出,其原因是__________________。
(5)将硫酸溶液滴入Ⅱ图实验后的烧杯中,至溶液显酸性,结果也有Cl2生成,其原因是(用离子反应方程式表示)__________________。
某同学用下列装置制备并检验Cl2的性质。
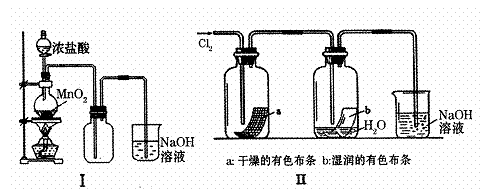
(1)I图圆底烧瓶中反应的化学方程式是 。
(2)II图中褪色的是 (填a或b),烧杯中反应的离子方程式是
。
(3)①将Cu丝换成Fe丝,做III实验,结果也能点燃,你认为Fe丝也可点燃的理由是 。
a.Fe与Cu都是金属元素 b.Fe的熔点比Cu高
c.Fe的密度比Cu小 d.Fe的金属性比Cu强
②通常由燃烧产物(FeCl3)配制其溶液的方法是
。
(4)将IV装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状液滴生成,量筒内液面上降。油状液滴的成分可能是(写分子式) ,
量筒内液面上升的原因是 。
(5)将硫酸溶液滴入II图烧杯中,至溶液显酸性,结果也有Cl2生成,该反应的离子方程式是 。
查看习题详情和答案>>