网址:http://m.1010jiajiao.com/timu3_id_78414[举报]
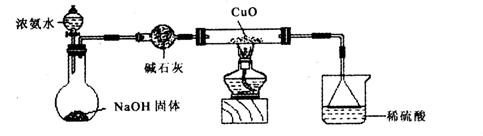
(1)证明氨气具有还原性。已知2NH3+3CuO![]() N2+3Cu+3H2O。
N2+3Cu+3H2O。
①碱石灰的作用是___________,稀硫酸的作用是____________________________________。
②浓氨水与固体NaOH接触,为什么会逸出大量氨气?
③证明NH3具有还原性的实验现象是_______________________________________________。
(2)用吸收了足量尾气的溶掖制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:
(NH4)2SO4+FeSO4+6H2O====(NH4)2Fe(SO4)2·6H2O。若溶液的pH>8.1,Fe2+将转化为沉淀。
①吸收了a mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,请简述实验方法。
②为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是__________________。
查看习题详情和答案>>2012年10月8日发布的修订版《机动车驾驶证申领和使用规定》,以其对违章驾驶员的严厉惩罚被人们称为“史上最严交规”,其中饮酒后驾驶机动车的一次记12分。利用如下测试管可检测司机是否酒后驾车,化学原理如下:

金属铬在化合物中主要有+3价和+6价两种价态。+6价铬化合物K2CrO4和K2Cr2O7在水溶液中分别呈黄色和橙色,它们在溶液中存在如下平衡关系:2CrO42-+2H+ Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。
Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。
(1)根据上述条件可知,在强酸性条件下+6价铬主要以 (填“CrO2-4”或“Cr2O2-7”)形式存在。如果司机酒后驾车,则测试管中的现象是 且超过法定警界线,反应的离子方程式为 。
(2)研究发现+6价铬的毒性为+3价铬的毒性的100~200倍,有多种方法可以将废水中的+6价铬转化为+3价铬以降低毒性。其中两种方法如下:
方法一:电化学方法。将含Cr2O2-7的酸性废水加适量NaCl搅拌均匀并以Fe作电极进行电解。在阳极产生的Fe2+将Cr2O2-7还原为Cr3+,在电解过程中溶液的pH不断上升,最终Cr3+和Fe3+以Cr(OH)3和Fe(OH)3沉淀的形式析出。
①请分析溶液pH不断上升的原因: 。
②已知Fe3+和Cr3+变为Fe(OH)3和Cr(OH)3沉淀的pH如下表:

当溶液的pH范围为____时,溶液中Fe3+已沉淀完全而Cr3+还没有开始沉淀。
③当电路中通过3mol电子时,理论可还原Cr2O2-7的物质的量为 mol。
方法二:还原沉淀法。将l0ml某含铬(Cr2O2-7)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀经干燥后为nmolFeO·FeyCrxO3。
④不考虑处理过程中的实际损耗,下列叙述错误的是
A.反应中发生转移的电子个数为3nx
B.该废水中c(Cr2O2-7)为50nx mol/L
C.消耗硫酸亚铁铵的物质的量为n(l+y)mol
D.在FeO·FeyCrxO3中,x+y=2
查看习题详情和答案>>
利用如图所示的装置和其他必要的仪器用品,完成下列实验。

(1)证明氨气具有还原性。已知2NH3+3CuO![]() N2+3Cu+3H2O。
N2+3Cu+3H2O。
①碱石灰的作用是 ,稀硫酸的作用是 。
②浓氨水与固体NaOH接触,为什么会逸出大量氨气?
。
③证明NH3具有还原性的实验现象是 。
(2)用吸收了足量尾气的溶液制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:(NH4)2SO4+FeSO4+6H2O==(NH4)2 Fe(SO4)2·6H2O。若溶液的pH>8.1,Fe外将转化为沉淀。
①吸收了![]() mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。
mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。
。
②为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是 。
查看习题详情和答案>>绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为 (保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为 (填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为 。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+→6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+→ 3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+→ NO↑+3Fe3++2H2O
① V值范围 ;
② 若V=48,试计算混合物中CuS的质量分数(保留两位小数)。
查看习题详情和答案>>
(1)重晶石(BaSO4)常做胃肠道造影剂.已知:常温下,Ksp(BaSO4)=1.1×10-10.向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)=
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]常做分析剂.等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4 c.(NH4)2SO4 d.(NH4)2SO3
其中c(NH4+)由大到小的顺序为
(3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂.
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为
②样品中K2S2O8的含量可用碘量法测定.操作步骤为称取0.3000g样品于碘量瓶中,加50mL水溶解;加入4.000g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以