摘要:7.将质量为W1 g的钠.铝混合物投入一定量的水中充分反应.金属没有剩余.溶液澄清.共收集到标准状况下的气体V1 L.向溶液中逐滴加入浓度为a mol/L的盐酸.过程中有白色沉淀生成后又逐渐溶解.当沉淀恰好消失时所加盐酸体积为V2 L.将溶液在HCl气氛中小心蒸干得固体W2 g.下列所列关系式中正确的是 ( ) A. 35.5a=(W2-W1) V2 B. n(Al)>mol C. n(Na)+3n(Al)=mol D. aV2= 答案:C 命题意图:考察高中化学钠和铝有关化学性质. 思路点拨:本题是一道综合了钠和铝有关化学性质的较难的计算型选择题.题目融合了化学中的“初态--终态 思想以及在化学选择和计算题中普遍使用的守恒法.根据题意.W1 g的Na和Al经过和一定量的水反应.置换出了V1 L H2.由电子得失守恒知:Na和Al完全反应变成Na+和Al3+失去的电子数应该等于生成的H2得到的电子数.则有n=2V1/22.4 ;且Al要完全溶解 .必须使生成的n.假设n.则有23n=W1,得n(Al)<W1/50 ;溶液经过一系列的反应最终得到的固体应该是NaCl和AlCl3的混合固体.因此.由“初态--终态 知W2-W1是盐酸中Cl元素的质量.则有35.5aV2=W2-W1 ,aV2可看成是盐酸中Cl元素的物质的量.由Cl元素守恒知aV2=n=2V1/22.4. 二 非选择题.
网址:http://m.1010jiajiao.com/timu3_id_77856[举报]
将质量为W1 g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1 L.向溶液中逐滴加入浓度为a mol/L的盐酸,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2 L,测得溶液中含盐酸盐溶质共W2 g.下列所列关系式中正确的是( )
| A、35.5a=(W2-W1)V2 | ||
B、n(Na)+3n(Al)=
| ||
C、n(Al)>
| ||
D、aV2=
|
将质量为W1 g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1 L。向溶液中逐滴加入浓度为a mol/L的盐酸,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2 L,将溶液在HCl气氛中小心蒸干得固体W2 g。下列所列关系式中正确的是 ( )
A. 35.5a=(W2-W1) V2
B. n(Al)>![]() mol
mol
C. n(Na)+3n(Al)=![]() mol
mol
D. aV2=![]()
将质量为W1 g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1 L。向溶液中逐滴加入浓度为a mol/L的盐酸,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2 L,将溶液在HCl气氛中小心蒸干得固体W2 g。下列所列关系式中正确的是
| A.35.5a=(W2-W1)V2 | B.n(Al)>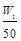 mol mol |
C.n(Na)+3n(Al)=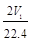 mol mol | D. aV2=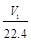 |
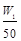 mol
mol 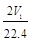 mol D. aV2=
mol D. aV2=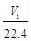
 mol
mol  mol
D. aV2=
mol
D. aV2=