网址:http://m.1010jiajiao.com/timu3_id_77242[举报]
(8分)用一定浓度的稀盐酸与稀NaOH溶液在左下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。已知强酸与强碱的中和热为57.3KJ/mol,水的比热容为4.2J/(g·℃),有关热量与比热容的计算公式:Q=m×c×△t(Q为热量,m为物质的质量,c为比热容,△t物质温度的变化值)
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是:
(2)将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
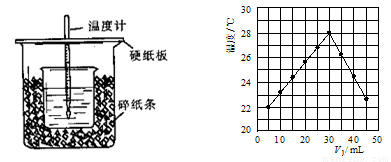
下列叙述正确的是
A.做该实验时环境温度为22 ℃ B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00 mol/L D.该实验表明有水生成的反应都是放热反应
(3)V1=30mL时HCl和NaOH恰好反应,根据题中所给数据算出的温度变化值约为
(保留整数,计算时可将稀溶液的密度及比热容看成与水近似相同,且溶液混合时体积变化忽略不计);而根据上图的温度变化可读出温度变化值约7 ℃;两者相比所测结果偏低,造成如此现象的原因有:
查看习题详情和答案>>
(8分)用一定浓度的稀盐酸与稀NaOH溶液在左下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。已知强酸与强碱的中和热为57.3KJ/mol,水的比热容为4.2J/(g·℃),有关热量与比热容的计算公式:Q=m×c×△t(Q为热量,m为物质的质量,c为比热容,△t物质温度的变化值)
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是:
(2)将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。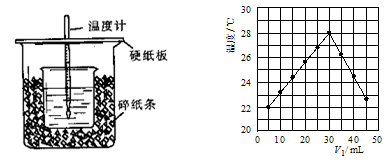
下列叙述正确的是
| A.做该实验时环境温度为22 ℃ | B.该实验表明化学能可以转化为热能 |
| C.NaOH溶液的浓度约是1.00 mol/L | D.该实验表明有水生成的反应都是放热反应 |
(保留整数,计算时可将稀溶液的密度及比热容看成与水近似相同,且溶液混合时体积变化忽略不计);而根据上图的温度变化可读出温度变化值约7 ℃;两者相比所测结果偏低,造成如此现象的原因有:
查看习题详情和答案>>
用一定浓度的稀盐酸与稀NaOH溶液在左下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。已知强酸与强碱的中和热为57.3KJ/mol,水的比热容为4.2J/(g·℃),有关热量与比热容的计算公式:Q=m×c×△t(Q为热量,m为物质的质量,c为比热容,△t物质温度的变化值)
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是:
(2)将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
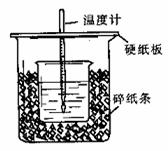
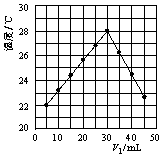
下列叙述正确的是
A.做该实验时环境温度为22 ℃ B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00 mol/L D.该实验表明有水生成的反应都是放热反应
(3)V1=30mL时HCl和NaOH恰好反应,根据题中所给数据算出的温度变化值约为
(保留整数,计算时可将稀溶液的密度及比热容看成与水近似相同,且溶液混合时体积变化忽略不计);而根据上图的温度变化可读出温度变化值约7 ℃;两者相比所测结果偏低,造成如此现象的原因有:
查看习题详情和答案>>
(12分)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
(1)研究小组做该实验时环境温度 (填“高于”、
“低于”或“等于”)22 ℃,判断的依据是 。
(2)由题干及图形可知,V1︰V2= 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为 mol/L。
(3)实验时将酸碱在简易量热计中混合,并用 搅拌,使溶液混合均匀。经有关计算知此反应共放出Q kJ的热量,请写出此反应的热化学方程式: 。
查看习题详情和答案>>
(8分) 某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1 盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)他们记录的实验数据如下:
|
实 验 用 品 |
溶 液 温 度 |
中和热△H |
|||
|
t1 |
t2 |
||||
|
① |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.3℃ |
|
|
② |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.5℃ |
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
计算完成上表。△H=
(3)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
研究小组做该实验时环境温度 (填“高于”、“低于”或“等于”)22 ℃,此反应所用NaOH溶液的浓度应为 mol/L。
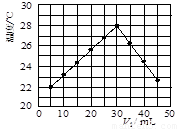
查看习题详情和答案>>