摘要: 浓度均为1 mol·L-1的NaCl溶液与MgSO4溶 液的导电能力相比( ) A.大于 B.小于 C.相同 D.不能确定
网址:http://m.1010jiajiao.com/timu3_id_76777[举报]
现有浓度均为1 mol?L-1的FeCl3、CuCl2、FeCl2的混合溶液100mL,向该溶液中加入5.6g铁粉,充分反应(溶液体积变化忽略不计).下列有关叙述不正确的是( )
| A、反应后的溶液中含有Fe2+、Cu2+、不含Fe3+ | B、反应后的溶液中含有Fe2+ 0.2 mol、Cu2+ 0.1mol | C、反应后的溶液中Fe2+的浓度增至0.3 mol?L-1 | D、反应后容器中残留固体为3.2 g |
选用一种试剂能把浓度均为1 mol·L-1的Na2SO4、Na2SO3、Na2CO3、Na2S、BaCl2溶液加以区别,这种试剂是
A.CaCl2溶液 B.稀硫酸 C.AgNO3 D.稀盐酸
查看习题详情和答案>>
A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1 mol·Lˉ1。反应进行2min后A的浓度为0.8 mol·Lˉ1,B的浓度为0.6 mol·Lˉ1,C的浓度为0.6 mol·Lˉ1。则2min内反应的平均速率VA=__________,VB=_____________,VC=___________。该反应的化学反应方程式为___________________________。
查看习题详情和答案>>
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,盐桥中装有饱和K2SO4溶液.回答下列问题:
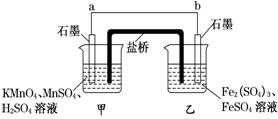
(1)发生氧化反应的烧杯是________(填“甲”或“乙”).
(2)外电路的电流方向为:从________到________.(填“a”或“b”)
(3)电池工作时,盐桥中的SO移向________(填“甲”或“乙”)烧杯.
(4)甲烧杯中发生的电极反应为______________________________________________.
查看习题详情和答案>>