网址:http://m.1010jiajiao.com/timu3_id_76219[举报]
(10分)“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101![]() 时:
时:![]()
![]()
则在25℃,101![]() 时:
时:![]() .
.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1100℃时测得高炉时,![]() ,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
③目前工业上可用![]() 来生产燃料甲醇,有关反应为:
来生产燃料甲醇,有关反应为:
![]() 。现向体积为1L的密闭容器中,充入1mol
。现向体积为1L的密闭容器中,充入1mol![]() 和3mol
和3mol![]() ,反应过程中测得
,反应过程中测得![]() 和
和![]() (g)的浓度随时间的变化如图所示。
(g)的浓度随时间的变化如图所示。
①从反应开始到平衡,氢气的平均反应速率 ;
;
②下列措施能使![]() 增大的是 (填符号)。
增大的是 (填符号)。
A.升高温度 B.再充入![]() C.再充入
C.再充入![]()
D.将![]() (g)从体系中分离 E.充入He(g),使体系压强增大
(g)从体系中分离 E.充入He(g),使体系压强增大
查看习题详情和答案>>
(10分)“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101![]() 时:
时:![]()
![]()
则在25℃,101![]() 时:
时:![]() .
.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1100℃时测得高炉时,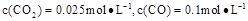 ,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
③目前工业上可用![]() 来生产燃料甲醇,有关反应为:
来生产燃料甲醇,有关反应为:
![]() 。现向体积为1L的密闭容器中,充入1mol
。现向体积为1L的密闭容器中,充入1mol![]() 和3mol
和3mol![]() ,反应过程中测得
,反应过程中测得![]() 和
和![]() (g)的浓度随时间的变化如图所示。
(g)的浓度随时间的变化如图所示。
①从反应开始到平衡,氢气的平均反应速率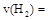 ;
;
②下列措施能使![]() 增大的是 (填符号)。
增大的是 (填符号)。
A.升高温度 B.再充入![]() C.再充入
C.再充入![]()
D.将![]() (g)从体系中分离 E.充入He(g),使体系压强增大
(g)从体系中分离 E.充入He(g),使体系压强增大
查看习题详情和答案>>
(10分)“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101 时:
时:

则在25℃,101 时:
时: .
.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
 ,已知在1100℃时,该反应的化学平衡常数K=0.263。
,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1100℃时测得高炉时,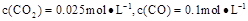 ,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是
。
,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是
。
③目前工业上可用 来生产燃料甲醇,有关反应为:
来生产燃料甲醇,有关反应为:
 。现向体积为1L的密闭容器中,充入1mol
。现向体积为1L的密闭容器中,充入1mol 和3mol
和3mol ,反应过程中测得
,反应过程中测得 和
和 (g)的浓度随时间的变化如图所示。
(g)的浓度随时间的变化如图所示。

①从反应开始到平衡,氢气的平均反应速率 ;[来源:]
;[来源:]
②下列措施能使 增大的是 (填符号)。
增大的是 (填符号)。
A.升高温度 B.再充入 C.再充入
C.再充入
D.将 (g)从体系中分离
E.充入He(g),使体系压强增大
(g)从体系中分离
E.充入He(g),使体系压强增大
查看习题详情和答案>>
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。
(1)某温度下,2SO2(g)+O2(g) 2SO3(g) △H=-197 kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。
2SO3(g) △H=-197 kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。
(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2,发生下列反应:
 2SO2(g)+O2(g)
2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是 (填字母)。
2SO2(g)+O2(g)
2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是 (填字母)。
A.恒温恒容,充入2mol SO3 B.恒温恒容,充入2mol N2
C.恒温恒压,充入1 mol SO3 D.升高温度
(3)在一密闭容器中进行下列反应:2SO2(g)+O2(g) 2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。
2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。
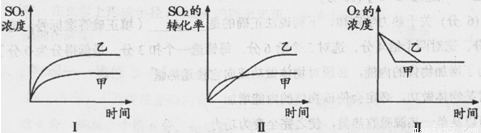
A.图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且乙的温度较低
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
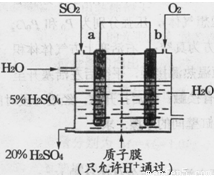
(4)某实验小组设想如下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式: 。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
SO2(g)+O2(g) 2SO3(g) △H1=-197 kJ/mol;
2SO3(g) △H1=-197 kJ/mol;
H2O(g)=H2O(1) △H2=-44 kJ/mol:
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(1) H3=-545 kJ/mol。
写出SO3(g)与H2O(1)反应的热化学方程式是 。
(6)由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,SO42-和CO32-的浓度之比 。[已知该温度时,Ksp(BaSO4)=1.3x10-10,KsP(BaCO3)=5.2x10-9]。
查看习题详情和答案>>
(10分)“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101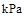 时:
时:

则在25℃,101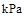 时:
时: .
.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
 ,已知在1100℃时,该反应的化学平衡常数K=0.263。
,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1100℃时测得高炉时, ,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是
。
,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是
。
③目前工业上可用 来生产燃料甲醇,有关反应为:
来生产燃料甲醇,有关反应为:
 。现向体积为1L的密闭容器中,充入1mol
。现向体积为1L的密闭容器中,充入1mol 和3mol
和3mol ,反应过程中测得
,反应过程中测得 和
和 (g)的浓度随时间的变化如图所示。
(g)的浓度随时间的变化如图所示。

①从反应开始到平衡,氢气的平均反应速率 ;
;
②下列措施能使 增大的是 (填符号)。
增大的是 (填符号)。
A.升高温度 B.再充入 C.再充入
C.再充入
D.将 (g)从体系中分离
E.充入He(g),使体系压强增大
(g)从体系中分离
E.充入He(g),使体系压强增大
查看习题详情和答案>>