摘要:已知:N2(g)+3H2(g)2NH3(g);ΔH<0;2SO2(g)+O2(g)2SO3(g);ΔH<0 完成下列问题: (1)从影响速率和平衡的因素分析.要有利于NH3和SO3的生成.理论上应采取的措施是 .实际生产中采取的措施分别是 . (2)在实际生产的合成氨过程中.要分离出氨气.目的是 ,而合成SO3过程中.不需要分离出SO3.原因是 . 解析:工业上合成SO3与合成氨的最大不同之处是该反应是在常压下进行的.原因是常压下该反应向生成SO3的方向进行程度已经很大.采用高压虽能使平衡向生成SO3方向移动.但产生高压既需要动力又对反应容器耐压性有较高要求.综合生产成本和经济效益两方面因素.实际生产时.在常压下进行最合理. 答案:(1)高温.高压.催化剂 合成氨:高温.高压.催化剂,合成SO3:高温.常压.催化剂 (2)减少生成物浓度.使平衡向生成NH3方向移动 该反应向生成SO3的方向进行程度大.达到平衡后SO2余量较少.故不需要分离SO3
网址:http://m.1010jiajiao.com/timu3_id_76126[举报]
(2010?南京二模)(1)在一定条件下,将1mol N2与3mol H2混合于一个10L密闭容器中,反应在不同温度下达到平稳时NH3的浓度如图1所示.其中,温度为T1时平稳混合气体中氨的体积分数为25%.
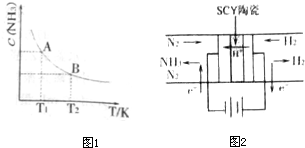
①当温度由T1变化到T2时,平稳常数KA
②T1温度达到平衡时N2的转化率为
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)此反应的△S
(已知:N2(g)+3H2(g)?2NH3(g)△=-92.44kJ/mol2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ/mol)
(3)科学家采用高质子导电性的SCY陶瓷(可传递H+),实现了低温常压下高转化率的电化学合成氨,其实验原理如图2所示,则阴极的电极反应式为
查看习题详情和答案>>

①当温度由T1变化到T2时,平稳常数KA
>
>
KB(填“>”、“<”或“=”)②T1温度达到平衡时N2的转化率为
40%
40%
.(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)此反应的△S
>
>
0(填“>”、“<”或“=”)△H+1530kJ/mol
+1530kJ/mol
.(已知:N2(g)+3H2(g)?2NH3(g)△=-92.44kJ/mol2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ/mol)
(3)科学家采用高质子导电性的SCY陶瓷(可传递H+),实现了低温常压下高转化率的电化学合成氨,其实验原理如图2所示,则阴极的电极反应式为
N2+6e-+6H+=2NH3
N2+6e-+6H+=2NH3
.
如图是工业生产硝酸铵的流程.
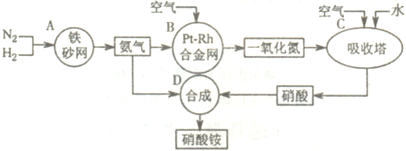
(1)A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母).
(2)已知:
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=一1266.8kJ/mol
N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
写出氨高温催化氧化的热化学方程式: ,
氨催化氧化反应的化学平衡常数表达式K= .
(3)已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol.为提高氢气的转化率,宜采取的措施有 .(填字母)
A.升高温度 B.使用催化剂 C.增大压强 D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为 .
查看习题详情和答案>>

(1)A、B、C、D四个容器中的反应,属于氧化还原反应的是
(2)已知:
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=一1266.8kJ/mol
N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
写出氨高温催化氧化的热化学方程式:
氨催化氧化反应的化学平衡常数表达式K=
(3)已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol.为提高氢气的转化率,宜采取的措施有
A.升高温度 B.使用催化剂 C.增大压强 D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为
(1)已知:N2(g)+O2(g)=2NO(g);△H=+180.5kJ?mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ?mol-1
2H2(g)+O2(g)=2H2O(g):△H=-483.6kJ?mol-1
则N2(g)+3H2(g)?2NH3(g)的△H= .
(2)在一定条件下,将2mol N2与5mol H2混合于一个10L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3) ;
②达到平衡时NH3的体积分数为 .
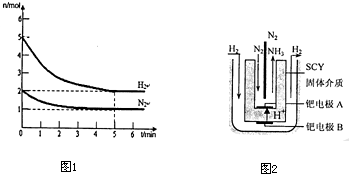
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2).钯电极A上发生的电极反应式是 .
查看习题详情和答案>>
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ?mol-1
2H2(g)+O2(g)=2H2O(g):△H=-483.6kJ?mol-1
则N2(g)+3H2(g)?2NH3(g)的△H=
(2)在一定条件下,将2mol N2与5mol H2混合于一个10L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3)
②达到平衡时NH3的体积分数为

(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2).钯电极A上发生的电极反应式是
按要求回答下列问题:
(1)硝酸是一种重要的化工原料,工业上用氨气作原料生产.写出氨被氧化生成一氧化氮的化学方程式
(2)盛放氢氧化钠溶液的试剂瓶必须用橡胶塞,而不能用磨D玻璃塞.请写出有关的离子反应方程式
(3)肼讲(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化刹,反应生成N2和水蒸气.
已知;
①N2(g)+2O2(g)=N2O4(g);△H=+8.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
写出肼和N2O4反应的热化学方程式
查看习题详情和答案>>
(1)硝酸是一种重要的化工原料,工业上用氨气作原料生产.写出氨被氧化生成一氧化氮的化学方程式
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(2)盛放氢氧化钠溶液的试剂瓶必须用橡胶塞,而不能用磨D玻璃塞.请写出有关的离子反应方程式
SiO2+2OH-=SiO32-+H2O
SiO2+2OH-=SiO32-+H2O
.(3)肼讲(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化刹,反应生成N2和水蒸气.
已知;
①N2(g)+2O2(g)=N2O4(g);△H=+8.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
写出肼和N2O4反应的热化学方程式
2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1076.7KJ/mol
2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1076.7KJ/mol
.