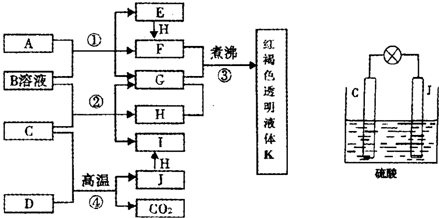
摘要: 已知A 是一种常见的盐.B .C .K 为常见金属.K 的氧化物是耐火材料.且能溶于碱溶液.G 为淡黄色固体.H .F 为无色气体.F 在空气中会变成红棕色.它们的转化关系如下图所示. 请回答下列问题: ( 1 ) A 的化学式为 ( 2 )在反应① ② ③ ④ 中属于置换反应的是 ( 3 )反应② 的离子方程式为 ( 4 )反应⑤ 的总反应化学方程式为 . *28. 已知某纯碱试样中含有NaCl杂质.为测定试样中纯碱的质量分数.可用下图中的装置进行实验. 主要实验步骤如下: ① 按图组装仪器.并检查装置的气密性 ② 用托盘天平称取6.0 g试样放入锥形瓶中.加适量蒸馏水溶解.得到试样溶液 ③ 称量盛有碱石灰的U型管的质量得到32.6 g ④ 从分液漏斗滴入6 mol·L-1的硫酸.直到不再产生气体时为止 ⑤ 从导管A处缓缓鼓入一定量的空气 ⑥ 再次称量盛有碱石灰的U型管的质量.得到34.8 g ⑦ 重复步骤⑤和⑥的操作.直到U型管的质量基本不变. 请填空和回答问题: (1)简述用托盘天平称取6.0g样品的操作步骤 . (2)在③步骤中称量质量时涉及到多步添加.撤去法码的操作.请用“↓ 表示在托盘上加上砝码.“↑ 表示从托盘上取下砝码的称量过程.(法码有50g.20g.10g.5g.2g.1g等多种规格.1g以下移动游码)注:表格可不填满 砝码质量/g 50 20 称量过程 ↓↑ (3)装置中干燥管B的作用是 (4)如果将分液漏斗中的硫酸换成浓度相同的盐酸.测试的结果 (5)步骤⑤的目的是 .A中NaOH溶液的作用是 . (6)步骤⑦的目的是 (7)该试样中纯碱的质量分数为 .
网址:http://m.1010jiajiao.com/timu3_id_75779[举报]
已知D、H是常见的非金属单质,其中H是黄绿色气体.J是一种金属单质,J元素的+2价化合物比+4价化合物稳定.D、J元素在周期表中同主族,D是形成化合物种类最多的元素.A、C是金属氧化物,C和J均是某种常见电池的电极材料,B与C反应时,每生成1mol H同时消耗4mol B和1mol C.它们之间的关系如图:
(1)写出物质A的化学式
(2)写出反应②的化学方程式
(3)由金属氧化物A和C得到其相应的金属单质,在冶金工业上一般可用
①热分解法 ②热还原法 ③电解法
其中从A得到其相应金属也可以用铝热法,若反应中lmolA参加反应,转移电子的物质的量为
(4)用C、J作电极,与硫酸构成如图所示电池,工作时电池发生的总反应式为
(5)向框图中的红褐色透明液体K中逐滴滴入HCl溶液.可以观察到先产生红褐色沉淀,后红褐色沉淀溶解,请解释原因
查看习题详情和答案>>
(1)写出物质A的化学式
Fe3O4
Fe3O4
.(2)写出反应②的化学方程式
PbO2+4HCl=PbCl2+Cl2↑+2H2O
PbO2+4HCl=PbCl2+Cl2↑+2H2O
.(3)由金属氧化物A和C得到其相应的金属单质,在冶金工业上一般可用
②
②
方法(填序号).①热分解法 ②热还原法 ③电解法
其中从A得到其相应金属也可以用铝热法,若反应中lmolA参加反应,转移电子的物质的量为
8
8
mol.(4)用C、J作电极,与硫酸构成如图所示电池,工作时电池发生的总反应式为
Pb+PbO2+2H2SO4=2PbSO4+2H2O
Pb+PbO2+2H2SO4=2PbSO4+2H2O
,当反应转移1mol电子时,溶液中消耗H+的物质的量为2
2
mol.(5)向框图中的红褐色透明液体K中逐滴滴入HCl溶液.可以观察到先产生红褐色沉淀,后红褐色沉淀溶解,请解释原因
开始加盐酸时,氢氧化铁胶体遇电解质发生聚沉,再继续滴加则氢氧化铁沉淀与盐酸发生酸碱中和反应,沉淀溶解
开始加盐酸时,氢氧化铁胶体遇电解质发生聚沉,再继续滴加则氢氧化铁沉淀与盐酸发生酸碱中和反应,沉淀溶解

A到L为常见物质或该物质的水溶液,且它们之间存在下图转变关系。已知:A为生活必需品;E元素在地壳中丰度较高,其单质大量用于制造导线和制造合金;C是酸式盐;H是普通干电池的重要成分;F是一种不溶于稀硝酸的白色沉淀;G的水溶液与少量的过氧化钠反应也可以得到K。?

完成下列问题:?
(1)A的晶体类型为: ,J在常温下是 色的气体。?
(2)写出H、K的化学式,H ,K 。?
(3)完成化学反应方程式:?
A+B→C+D: 。?
(4)写出下列反应的离子方程式:?
C+E→H2+混合物: ;?
G+氨水→K+L: 。
查看习题详情和答案>>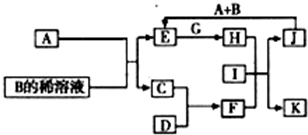 A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.(1)工业上冶炼金属A的方法称为
热还原法
热还原法
.(2)向E的溶液中加入氢氧化钠溶液的实验现象为
先生成白色沉淀,迅速变为灰绿色,最后变为红褐色
先生成白色沉淀,迅速变为灰绿色,最后变为红褐色
,反应的化学方程式为FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3
FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3
.(3)写出E的酸性溶液与G反应转化为H的离子方程式
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.(4)相同条件下物质的量浓度相同的K、L溶液的pH大小关系为K
>
>
L(用“>”、“<”或“=”表示),其主要原因是(用化学用语说明)NH4++H2O?NH3?H2O+H+,HSO4-═H++SO42-
NH4++H2O?NH3?H2O+H+,HSO4-═H++SO42-
.A~L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去)。已知A为金属单质,C、D通常状况下为气体单质。B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L。G和I分别由相同的两种元素组成,通常状况下均为无色液体。
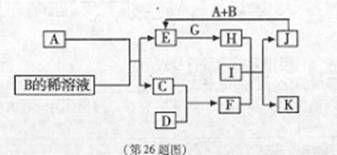
(1)B的化学式为 ;工业上冶炼金属A的方法称为 。
(2)向E的溶液中加入氢氧化钠溶液的实验现象为 ,反应的化学方程式为 。
(3)写出E的酸性溶液与G反应转化为H的离子方程式 。
(4)相同条件下物质的量浓度相同的K、L溶液的pH大小关系为K L(用“>”、“<”或“=”表示),其主要原因是(用化学用语说明) 。
查看习题详情和答案>>
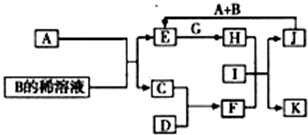 A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.