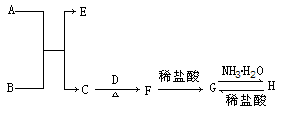
摘要:19.(2009·山东省枣庄市高三第一学期期末测试)某可逆反应的反应过程中能量变化如下图所示.回答下列问题. (1)若E1=215kJ·mol-1.E2=625kJ·mol-1.则该反应的热化学方程式为 . (2)当反应达到平衡时.降低温度.A的转化率 (填“增大 “减小 或“不变 ).原因是 . (3)该反应的平衡常数表达式为K= .升高温度平衡常数K (填“增大 .“减小 .“不变 或“可能增大.也可能减小 ). (4)在反应体系中加入催化剂.反应速率增大.则 . A.E1减小.E2减小.反应热不变 B.E1减小.E2减小.反应热减小 C.E1减小.E2增大.反应热减小 D.E1增大.E2增大.反应热增大 答案: C ΔH=-410kJ·mol-1 (2)增大 降低温度.平衡向放热反应方向移动.A的转化率增大 (3)[C][D]/[A][ B]2 减小 (4)A
网址:http://m.1010jiajiao.com/timu3_id_75241[举报]
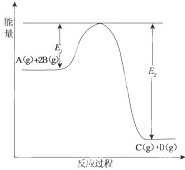 某可逆反应的反应过程中能量变化如图所示,回答下列问题.
某可逆反应的反应过程中能量变化如图所示,回答下列问题.(1)若E1=215kJ?mol-1,E2=625kJ?mol-1,则该反应的热化学方程式为:A(g)+2B(g)═C(g)+D(g)△H=
-410kJ?mol-1
-410kJ?mol-1
.(2)当反应达到平衡时,降低温度,A的转化率增大
增大
增大
(填“增大”“减小”或“不变”),原因是_降低温度,平衡朝放热方向移动,即朝正方向移动降低温度,平衡向放热反应方向(即正反应方向)移动,A的转化率增大
降低温度,平衡向放热反应方向(即正反应方向)移动,A的转化率增大
.(3)在反应体系中加入催化剂,反应速率增大,则
A
A
(用字母代号填空).
A.E1减小,E2减小,反应热不变
B.E1减小,E2减小,反应热减小
C.E1减小,E2增大,反应热减小
D.E1增大,E2增大,反应热增大.
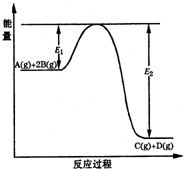 某可逆反应的反应过程中能量变化如图所示,回答下列问题.
某可逆反应的反应过程中能量变化如图所示,回答下列问题.(1)若E1=215kJ?mol-1,E2=625kJ?mol-1,则该反应的热化学方程式为
A(g)+2B(g)=C(g)+D(g)△H=-410kJ?mol-1
A(g)+2B(g)=C(g)+D(g)△H=-410kJ?mol-1
.(2)当反应达到平衡时,降低温度,A的转化率
增大
增大
(填“增大”“减小”或“不变”),原因是降低温度,平衡向放热反应方向(即正反应方向)移动,A的转化率增大
降低温度,平衡向放热反应方向(即正反应方向)移动,A的转化率增大
.(3)该反应的平衡常数表达式为K=
| c(C)c(D) |
| c(A)c2(B) |
| c(C)c(D) |
| c(A)c2(B) |
减小
减小
(填“增大”、“减小”、“不变”或“可能增大,也可能减小”).(4)在反应体系中加入催化剂,反应速率增大,则
A
A
(用字母代号填空).A.E1减小,E2减小,反应热不变; B.E1减小,E2减小,反应热减小
C.E1减小,E2增大,反应热减小; D.E1增大,E2增大,反应热增大.
某可逆反应的反应过程中能量变化如图所示,回答下列问题.
(1)若E1=215kJ?mol-1,E2=625kJ?mol-1,则该反应的热化学方程式为
______.
(2)当反应达到平衡时,降低温度,A的转化率______(填“增大”“减小”或“不变”),原因是______.
(3)该反应的平衡常数表达式为K=______,升高温度平衡常数K______(填“增大”、“减小”、“不变”或“可能增大,也可能减小”).
(4)在反应体系中加入催化剂,反应速率增大,则______(用字母代号填空).
A.E1减小,E2减小,反应热不变; B.E1减小,E2减小,反应热减小
C.E1减小,E2增大,反应热减小; D.E1增大,E2增大,反应热增大.
 查看习题详情和答案>>
查看习题详情和答案>>
(1)若E1=215kJ?mol-1,E2=625kJ?mol-1,则该反应的热化学方程式为
______.
(2)当反应达到平衡时,降低温度,A的转化率______(填“增大”“减小”或“不变”),原因是______.
(3)该反应的平衡常数表达式为K=______,升高温度平衡常数K______(填“增大”、“减小”、“不变”或“可能增大,也可能减小”).
(4)在反应体系中加入催化剂,反应速率增大,则______(用字母代号填空).
A.E1减小,E2减小,反应热不变; B.E1减小,E2减小,反应热减小
C.E1减小,E2增大,反应热减小; D.E1增大,E2增大,反应热增大.
 查看习题详情和答案>>
查看习题详情和答案>>
某可逆反应的反应过程中能量变化如下图所示,回答下列问题。
(1)若E1=215kJ?mol-1,E2=625kJ?mol-1,则该反应的热化学方程式为 。
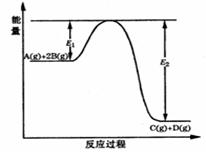 (2)当反应达到平衡时,降低温度,A的转化率
(2)当反应达到平衡时,降低温度,A的转化率
(填“增大”“减小”或“不变”),原因 是 。
(3)该反应的平衡常数表达式为K= ,升高温度平衡常数K (填“增大”、“减小”、“不变”或“可能增大,也可能减小”)。
(4)在反应体系中加入催化剂,反应速率增大,则 (用字母代号填空)。
A.E1减小,E2减小,反应热不变 B.E1减小,E2减小,反应热减小
C.E1减小,E2增大,反应热减小 D.E1增大,E2增大,反应热增大
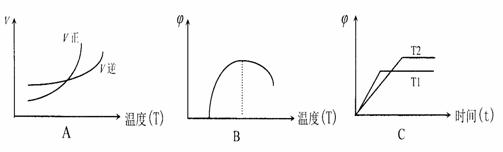
(5)在一个容积不变的容器中加入一定量的A和B发生上述反应,下列图像符合该反
应的是____ (填序号)(图中v是速率、∅为气体D的体积分数,T为温度)
查看习题详情和答案>>