摘要:5.1 g+17 g·mol-1×0.5 mol=13.6 g. 答案:C
网址:http://m.1010jiajiao.com/timu3_id_74882[举报]
(12分)由周期表中前20号元素组成的单质X2、Y和化合物Z的有关信息如下表,X2、Y 和Z之间的转化关系如下图(其他无关物质已略去)。请回答下列问题:
| 单质X2 | 标准状况下密度为3.17 g?L-1 |
| 单质Y | 通常状况下为一种淡黄色固体 |
| 化合物Z | 焰色反应呈紫色(透过蓝色钴玻璃观察) |
| 常温下0.1 mol?L-1 Z的水溶液pH=13 |
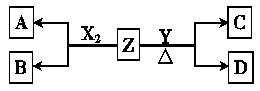
(1) Z的电子式为 。
(2)已知16 g固态单质Y在空气中完全燃烧放出148 kJ热量,则该反应的热化学方程式为 。
(3)已知C能与稀硫酸反应生成能使品红溶液褪色的气体,D中所含阴、阳离子的电子层排布相同。
①常温下D的水溶液pH>7,其原因是(用离子方程式表示) 。
②将20 mL 0.5 mol?L-1 C溶液逐滴加入20 mL 0.2 mol?L-1 KMnO4溶液(硫酸酸化)中,溶液恰好变为无色。写出该反应的离子方程式: 。
(4)①用石墨和铁作电极,在隔膜电解槽中电解A的溶液,阳极产生X2,电解A溶液的离子方程式为 。
②实验室常用含X元素的一种化合物E制取O2 ,工业上用无隔膜电解槽(石墨和铁作电极,温度为42~44 ℃)电解A的溶液生产化合物E。假设电解时电解槽进液口溶液中A 的浓度为2 mol?L-1,液口溶液中A的浓度为1.6 mol?L-1(进出口流量相同),则液口溶液中E的浓度为
mol?L-1。
查看习题详情和答案>>