摘要:1597.1.56g某碱金属单质与足量盐酸反应.得到标准状况下的.该金属的相对原子质量为( ) A.85 B.24 C.39 D.7
网址:http://m.1010jiajiao.com/timu3_id_74846[举报]
用如图所示装置测定某碱金属的相对原子质量。仪器本身连同水及干燥管内的无水氯化钙的总质量为480.00g。现将1.46g某碱金属单质投入水中,立即用带有干燥管的塞子塞住瓶口,反应完毕后,测得整套仪器的总质量为481.25g。该金属元素的相对原子质量是________;若不用干燥管,测得的相对原子质量比实际的相对原子质量________(填“大”、“小”或“相等”),理由是________________________________。

查看习题详情和答案>>
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y、的单质是生活中常见的金属,相关物质间的关系如下图所示.

回答下列问题:
(1)X的单质与A反应的化学方程式是
(2)若C溶液显碱性,则试剂1是
(3)若试剂1和试剂2均是稀硫酸.
①检验物质D的溶液中金属离子的方法是
②写出D-E反应的离子方程式
③某高效净水剂是由Y(OH)SO4聚合得到的.工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是(不必配平):
查看习题详情和答案>>

回答下列问题:
(1)X的单质与A反应的化学方程式是
Fe2O3+2Al
Al2O3+2Fe
| ||
Fe2O3+2Al
Al2O3+2Fe
.
| ||
(2)若C溶液显碱性,则试剂1是
NaOH(或KOH)
NaOH(或KOH)
溶液(写化学式);若C溶液显酸性,则显酸性的原因是(用离子方程式表示)Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
.(3)若试剂1和试剂2均是稀硫酸.
①检验物质D的溶液中金属离子的方法是
取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
;②写出D-E反应的离子方程式
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
;③某高效净水剂是由Y(OH)SO4聚合得到的.工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是(不必配平):
2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑
2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑
.现有四种单质组成的合金A,为分析其成分,用此合金进行一系列实验,其过程及发生反应的现象如下图所示.
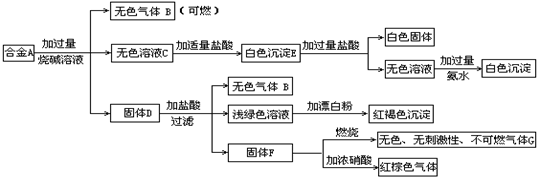
填写下列空白:
(1)A中含单质为为
(2)写出A中的某一单质与烧碱溶液反应的离子方程式
(3)写出固体F与硝酸反应的化学方程式,并标出电子转移的方向和数目

(4)将F与浓硝酸反应产生的气体依次通过足量的碳酸氢钠溶液、浓硫酸、足量Na2O2固体、水最终得到的气体与原气体的体积比为
查看习题详情和答案>>

填写下列空白:
(1)A中含单质为为
Al、Si、C、Fe
Al、Si、C、Fe
写化学式)(2)写出A中的某一单质与烧碱溶液反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑或Si+2OH-+H2O=SiO32-+2H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑或Si+2OH-+H2O=SiO32-+2H2↑
(3)写出固体F与硝酸反应的化学方程式,并标出电子转移的方向和数目


(4)将F与浓硝酸反应产生的气体依次通过足量的碳酸氢钠溶液、浓硫酸、足量Na2O2固体、水最终得到的气体与原气体的体积比为
1:6
1:6
.A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,Y的用量最大.相关物质间的关系如图所示.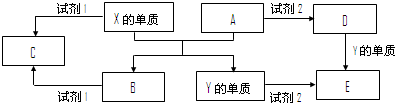
(1)X的单质与A反应的化学方程式是
(2)若试剂1是NaOH溶液,①X的单质与试剂1反应的离子方程式是
②4.5克X的单质参加反应转移的电子数
(3)若试剂1和试剂2均是稀硫酸.
①检验物质D的溶液中金属离子的方法是:
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)
③某高效净水剂是由Y(OH)SO4聚合得到的.工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是:
查看习题详情和答案>>

(1)X的单质与A反应的化学方程式是
Fe2O3+2Al
Al2O3+2Fe
| ||
Fe2O3+2Al
Al2O3+2Fe
.
| ||
(2)若试剂1是NaOH溶液,①X的单质与试剂1反应的离子方程式是
2Al+2H2O+2OH-═2AlO2-+3H2↑
2Al+2H2O+2OH-═2AlO2-+3H2↑
.②4.5克X的单质参加反应转移的电子数
3.01×1023
3.01×1023
.(3)若试剂1和试剂2均是稀硫酸.
①检验物质D的溶液中金属离子的方法是:
取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
.②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)
Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
.③某高效净水剂是由Y(OH)SO4聚合得到的.工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是:
2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑
2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑
.