网址:http://m.1010jiajiao.com/timu3_id_74492[举报]
某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。
该小组设计的简易实验装置如图所示:
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol/L的盐酸溶液;
②用________(填仪器名称并注明规格)量取10.0 mL 1.0 mol/L的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法:
___________________________________________________
(2)实验步骤⑤中应选用________(填序号)的量筒。
A.100 mol B.200 mL C.500 mL
读数时除恢复到室温外,还要注意_________________________________________。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=________,若未除去镁条表面的氧化膜,则测量结果________(填“偏大”、“偏小”或“无影响”)。
某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。
该小组设计的简易实验装置如图所示:
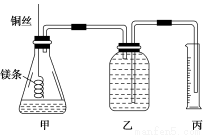
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol/L的盐酸溶液;
②用________(填仪器名称并注明规格)量取10.0 mL 1.0 mol/L的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法:
___________________________________________________
(2)实验步骤⑤中应选用________(填序号)的量筒。
A.100 mol B.200 mL C.500 mL
读数时除恢复到室温外,还要注意_________________________________________。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=________,若未除去镁条表面的氧化膜,则测量结果________(填“偏大”、“偏小”或“无影响”)。
查看习题详情和答案>>
该小组设计的简易实验装置如图所示:
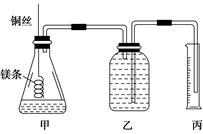
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol/L的盐酸溶液;
②用________(填仪器名称并注明规格)量取10.0 mL 1.0 mol/L的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法:
___________________________________________________
(2)实验步骤⑤中应选用________(填序号)的量筒。
A.100 mol B.200 mL C.500 mL
读数时除恢复到室温外,还要注意_________________________________________。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=________,若未除去镁条表面的氧化膜,则测量结果________(填“偏大”、“偏小”或“无影响”)。
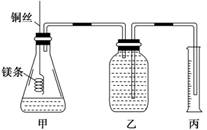 |
(探究创新题)某研究性学习小组欲测定室温下(25℃、101 kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如图所示:
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol·L-1的盐酸溶液;
②用 (填仪器名称并注明规格)量取10.0 mL 1.0 mol·L-1的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少
为 ;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法: 。
(2)实验步骤⑤中应选用 (填序号)的量筒。
A.100 mL B.200 mL C.500 mL
读数时除恢复到室温外,还要注意 。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm= ,若未除去镁条表面的氧化膜,则测量结果 (填“偏大”、“偏小”或“无影响”)。
查看习题详情和答案>>
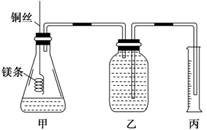 |
(探究创新题)某研究性学习小组欲测定室温下(25℃、101 kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如图所示:
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol·L-1的盐酸溶液;
②用 (填仪器名称并注明规格)量取10.0 mL 1.0 mol·L-1的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少
为 ;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法: 。
(2)实验步骤⑤中应选用 (填序号)的量筒。
A.100 mL B.200 mL C.500 mL
读数时除恢复到室温外,还要注意 。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm= ,若未除去镁条表面的氧化膜,则测量结果 (填“偏大”、“偏小”或“无影响”)。
查看习题详情和答案>>