摘要:95.若将浓硫酸和浓硝酸分别融口放置.它们的质量变化和放置天数的关系如右图所示.则有关曲线a.b变化原因的分析正确的是 A.a 升华.b冷凝 B a挥发.b吸水 C.a蒸发.b潮解 D a冷凝 .b 吸水
网址:http://m.1010jiajiao.com/timu3_id_74303[举报]
若将浓硫酸和浓硝酸分别敞口放置,它们的质量变化和放置天数的关系如图所示,则有关曲线a、b变化 原因的分析正确的是
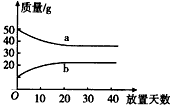
[ ]
A.a升华、b冷凝
B.a挥发、b吸水
C.a蒸发、b潮解
D.a冷凝、b吸水
查看习题详情和答案>>
B.a挥发、b吸水
C.a蒸发、b潮解
D.a冷凝、b吸水
铝及其化合物在生产生活中应用广泛.
(1)Al4C3用于冶金及催化剂.与盐酸反应(产物之一是含氢量最高的烃)的化学方程式是: ;14.4g Al4C3与盐酸反应产生的气体是 L(标准状况).
(2)AlN用于电子仪器.AlN中常混有少量碳,将一定量含杂质碳的AlN样品置于密闭反应器中,通入4.032L(标准状况下的)O2,在高温下充分反应后测得气体的密度为1.34g/L(已折算成标准状况,AlN不跟O2反应),则所得气体的摩尔质量为 g/mol,该气体的成分是 (写化学式),该样品中含杂质碳 g.
(3)氯李子插层镁铝水滑石是一种新型的离子交换材料.制备这种水滑石的过程是:MgCl2、AlCl3、NaOH、NaCl溶液,按一定比例混合,在65℃充分反应后,经过滤、洗涤、干燥得到该水滑石.为确定该水滑石的成分,进行下列操作:①取26.65g样品,在高温下使其充分分解,得到金属氧化物和气体,气体一次通过足量的浓硫酸和浓氢氧化钠溶液,这两种液体分别增重9.9g和3.65g;将金属氧化物在无色火焰上灼烧,火焰仍无色.②另取26.65g样品,加入足量的稀硝酸,使其完全溶解,再加入NaOH溶液至过量,最终得到11.6g白色沉淀.通过计算确定氯离子插层镁铝水滑石的化学式.
(4)氯离子插层镁铝水滑石在空气中放置,缓慢与CO2反应,部分氯离子会被碳酸根离子代替.26.65g样品在空气中放置一段时间后质量变为25.925g,则碳酸根离子代替部分氯离子的水滑石的化学式是 ,此过程的化学方程式 .
查看习题详情和答案>>
(1)Al4C3用于冶金及催化剂.与盐酸反应(产物之一是含氢量最高的烃)的化学方程式是:
(2)AlN用于电子仪器.AlN中常混有少量碳,将一定量含杂质碳的AlN样品置于密闭反应器中,通入4.032L(标准状况下的)O2,在高温下充分反应后测得气体的密度为1.34g/L(已折算成标准状况,AlN不跟O2反应),则所得气体的摩尔质量为
(3)氯李子插层镁铝水滑石是一种新型的离子交换材料.制备这种水滑石的过程是:MgCl2、AlCl3、NaOH、NaCl溶液,按一定比例混合,在65℃充分反应后,经过滤、洗涤、干燥得到该水滑石.为确定该水滑石的成分,进行下列操作:①取26.65g样品,在高温下使其充分分解,得到金属氧化物和气体,气体一次通过足量的浓硫酸和浓氢氧化钠溶液,这两种液体分别增重9.9g和3.65g;将金属氧化物在无色火焰上灼烧,火焰仍无色.②另取26.65g样品,加入足量的稀硝酸,使其完全溶解,再加入NaOH溶液至过量,最终得到11.6g白色沉淀.通过计算确定氯离子插层镁铝水滑石的化学式.
(4)氯离子插层镁铝水滑石在空气中放置,缓慢与CO2反应,部分氯离子会被碳酸根离子代替.26.65g样品在空气中放置一段时间后质量变为25.925g,则碳酸根离子代替部分氯离子的水滑石的化学式是
(2008?安庆模拟)下列实验操作正确且能达到预期目的是( )
|
查看习题详情和答案>>
盐酸、硫酸和硝酸是中学阶段常见的三种强酸.
Ⅰ.请就三者与金属铜的反应情况,回答下列问题:
(1)在100mL、18mol?L-1 的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准情况下的体积可能是
A.40.32L B.30.24L C.20.16L D.6.72L
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
(3)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水.该反应的化学方程式为
Ⅱ.用如下装置可以完成HCl的制取及后续一系列的性质实验(图中夹持装置已略去).
请回答下列问题:
(1)装置A选用浓硫酸和浓盐酸混合制取HCl气体,p中盛装试剂为
(2)装置B中的四处棉花依次做了如下处理:①包有某潮湿的固体物质 ②蘸有KI溶液③蘸有石蕊溶液 ④蘸有浓NaOH溶液.反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式
a.MnO2 b.KmnO4 C.KCl d.Cu
(3)在整个实验过程中,在③处能观察到的现象是
查看习题详情和答案>>
Ⅰ.请就三者与金属铜的反应情况,回答下列问题:
(1)在100mL、18mol?L-1 的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准情况下的体积可能是
D
D
A.40.32L B.30.24L C.20.16L D.6.72L
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是
NO2、NO
NO2、NO
,反应中所消耗的硝酸的物质的量可能为B
B
.A.0.1mol B.0.15mol C.0.2mol D.0.25mol
(3)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水.该反应的化学方程式为
Cu+H2O2+2HCl=CuCl2+2H2O
Cu+H2O2+2HCl=CuCl2+2H2O
.Ⅱ.用如下装置可以完成HCl的制取及后续一系列的性质实验(图中夹持装置已略去).

请回答下列问题:
(1)装置A选用浓硫酸和浓盐酸混合制取HCl气体,p中盛装试剂为
浓硫酸
浓硫酸
.(2)装置B中的四处棉花依次做了如下处理:①包有某潮湿的固体物质 ②蘸有KI溶液③蘸有石蕊溶液 ④蘸有浓NaOH溶液.反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式
CI2+2I-=2Cl-+I2
CI2+2I-=2Cl-+I2
.在①处包有的固体物质可能是a.MnO2 b.KmnO4 C.KCl d.Cu
(3)在整个实验过程中,在③处能观察到的现象是
先变红后褪色
先变红后褪色
.