网址:http://m.1010jiajiao.com/timu3_id_73395[举报]
在实验室中进行合成氨工业的模拟实验,当反应进行一段时间并建立平衡以后,及时分离出氨并补充与起始原料比相同的氮气和氢气,以实现连续的生产过程,一定条件下在1L的密闭容器中发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH<0
2NH3(g);ΔH<0
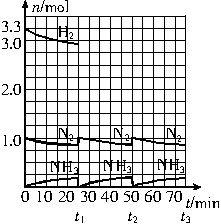
请根据图示回答下列问题:
(1)反应起始时,氮气与氢气的物质的量之比n(N2)∶n(H2)=______。在15min时合成氨反应第一次达到平衡,以这段时间内H2的浓度变化表示的平均化学反应速率为________。
(2)在t1时,曲线发生变化的原因是_________________、________________。请计算氢气在t1起点时的坐标(_______,______)以及在t2平衡时的坐标(____,____)。
(3)为达到图示中t2时的平衡状态,在t1~t2之间需要采取的措施是___________________。
A.扩大容器的容积 B.升高温度 C.降低温度 D.缩小容器的容积
(4)经历十次上述的循环过程,计算在t11平衡时,N2和H2的物质的量之比n(N2)∶n(H2)=_____________,整个过程中N2和H2的总转化率之比α(N2)∶α(H2)=_________。
N2(g)+3H2(g) ![]() 2NH3(g);ΔH<0
2NH3(g);ΔH<0

请根据图示回答下列问题:
(1)反应起始时,氮气与氢气的物质的量之比n(N2)∶n(H2)= _________∶_________。在15分钟时合成氨反应第一次达到平衡,其间以H2的浓度变化所表示的平均化学反应速率为_________________________。
(2)在t1时,曲线发生变化的原因是__________________、__________________。请计算氢气在t1起点时的坐标(_________,_________)以及在t2平衡时的坐标(_________,_________)。并在图中画出在t1—t2之间氢气的物质的量变化曲线。
(3)为达到图示中t2的平衡状态,在t1—t2之间需要采取的措施是_________。
a.扩大容器的体积
b.升高温度
c.降低温度
d.缩小容器的体积
(4)经历十次上述的循环过程,计算在t11达到平衡时,N2和H2的物质的量之比n(N2)∶n(H2)= _________∶_________,整个过程中N2和H2的总转化率之比α(N2)∶α(H2)= _________∶_________。
(5)根据以上计算结果,请你建议合成氨反应的最佳原料比是:n(N2)∶n(H2)=_________。
查看习题详情和答案>>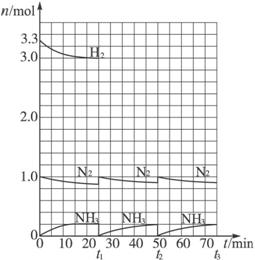
请根据图示回答下列问题:
(1)反应起始时,氮气与氢气的物质的量之比n(N2)∶n(H2)=___________。在25 min时合成氨反应第一次达到平衡,其间以H2的浓度变化所表示的平均化学反应速率为_________。
(2)在t1时,曲线发生变化的原因是_______________、_______________。请计算氢气在变化后t1起点时的坐标(___________,___________)以及在t2平衡时的坐标(___________,___________)。
(3)经历十次上述的循环过程,计算在t11达到平衡时,N2和H2的物质的量之比n(N2)∶n(H2)=___________,整个过程中N2和H2的总转化率之比α(N2)∶α(H2)=___________。
(4)根据以上计算结果,请你建议合成氨反应的最佳原料比是:n(N2)∶n(H2)=_________。
查看习题详情和答案>>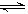 2NH3(g);ΔH<0。请根据图示回答下列问题:
2NH3(g);ΔH<0。请根据图示回答下列问题: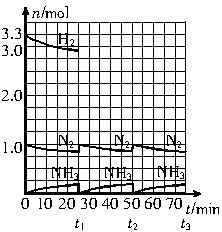
(1)反应起始时,氮气与氢气的物质的量之比
n(N2)∶n(H2)=_________。在15min时合成氨反应第一次达到平衡,其间以H2的浓度变化所表示的平均化学反应速率为_______。
(2)在t1时,曲线发生变化的原因是__________
_____________________。请计算氢气在t1起点时的坐标(_____,_____),以及在t2平衡时的坐标(____,____)。
(3)为达到图示中t2的平衡状态,在t1~t2之间需要采取的措施是______。
a.扩大容器的容积 b.升高温度 c.降低温度 d.缩小容器的容积
(4)经历十次上述的循环过程,计算在t11达到平衡时,N2和H2的物质的量之比n(N2)∶n(H2)=________,整个过程中N2和H2的总转化率之比α(N2)∶α(H2)=_____。 查看习题详情和答案>>
在实验室中进行合成氨工业的模拟实验,当反应进行一段时间,并建立相应的平衡以后,及时分离出氨并补充与起始原料比相同的氮气和氢气,以实现连续的生产过程,在
1 L的密封容器中,一定条件下会发生如下反应:N2(g)+3H2(g)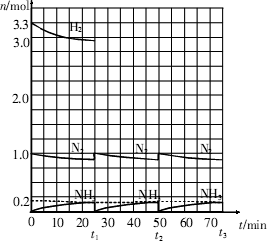
请根据上图所示回答下列问题:
(1)在t1时,曲线发生变化的原因是________.请计算氢气在t1起点时的坐标(________,________)以及在t2平衡时的坐标(________,________).
(2)经历十次上述循环过程后,在t11达到平衡时,N2和H2的物质的量之比为n(N2)∶n(H2)=________,整个过程中N2和H2的总转化率之比α(N2)∶α(H2)=________.