摘要:18.某化学研究性学习小组在实验室中模拟海水提取溴的过程.其实验流程如下: 海水除去悬浮杂质 氧化剂氧化 Br2(g) Na2CO3溶液吸收[NaBrNaBrO3]Br2 (1)取24 L除去悬浮杂质后的海水.浓缩至2 L, (2)向其中通入足量Cl2.反应的离子方程式: .通入热空气的目的: , (3)将吹出的Br2用纯碱溶液吸收.反应得到NaBr.NaBrO3和CO2.反应的化学方程式: .产生的CO2通入足量澄清石灰水中.得到1 g白色沉淀, (4)将吸收Br2的溶液用足量硫酸处理得到Br2.反应的化学方程式为 .理论上可以得到Br2的质量为 , (5)请计算海水中溴的浓度为 g/L. 解析:通过反应Cl2+2Br-===Br2+2Cl-置换出溴单质后.一般用热空气或水蒸气将Br2吹出,根据各步反应.可确定如下关系:Br2-CO2-CaCO3.根据CaCO3的质量可求出原24 L海水中Br2的质量为=1.6 g.则海水中溴的浓度为=0.067 g/L. 答案:(2)Cl2+2Br-===Br2+2Cl- 将Br2吹出 (3)3Br2+3Na2CO3===5NaBr+NaBrO3+3CO2↑ (4)5NaBr+NaBrO3+3H2SO4===3Br2+3Na2SO4+3H2O 1.6 g (5)0.067
网址:http://m.1010jiajiao.com/timu3_id_72908[举报]
某化学研究性学习小组在实验室中模拟海水提取溴的过程,其实验流程如下:
海水
Br2(g)

Br2
(1)取24L除去悬浮杂质后的海水,浓缩至2L;
(2)向其中通入足量Cl2,反应的离子方程式:
(3)将吹出的Br2用纯碱溶液吸收,反应得到NaBr、NaBrO3和CO2,反应的化学方程式:
(4)将吸收Br2的溶液用足量硫酸处理得到Br2单质,反应的化学方程式:
(5)请计算海水中溴的浓度为
查看习题详情和答案>>
海水
| 除去悬浮 |
| 杂质 |
| 浓缩 |
| 氯化剂 |
| 氯化 |
| 热空气 |
| Na2CO3溶液 |
| 吸收 |

| H2SO4 |
(1)取24L除去悬浮杂质后的海水,浓缩至2L;
(2)向其中通入足量Cl2,反应的离子方程式:
Cl2+2Br-═Br2+2Cl-
Cl2+2Br-═Br2+2Cl-
,通入热空气的目的:将Br2吹出
将Br2吹出
;(3)将吹出的Br2用纯碱溶液吸收,反应得到NaBr、NaBrO3和CO2,反应的化学方程式:
3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑
3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑
,产生的CO2通入足量澄清石灰水中,得到1g白色沉淀;(4)将吸收Br2的溶液用足量硫酸处理得到Br2单质,反应的化学方程式:
5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O
5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O
,理论上可以得到Br2的质量为1.6g
1.6g
;(5)请计算海水中溴的浓度为
0.067
0.067
g/L.某化学研究性学习小组在实验室中模拟海水提取溴的过程,其实验流程如下:
海水
Br2(g)
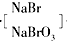
Br2
(1)取24L除去悬浮杂质后的海水,浓缩至2L;
(2)向其中通入足量Cl2,反应的离子方程式: ,通入热空气的目的: ;
(3)将吹出的Br2用纯碱溶液吸收,反应得到NaBr、NaBrO3和CO2,反应的化学方程式: ,产生的CO2通入足量澄清石灰水中,得到1g白色沉淀;
(4)将吸收Br2的溶液用足量硫酸处理得到Br2单质,反应的化学方程式: ,理论上可以得到Br2的质量为 ;
(5)请计算海水中溴的浓度为 g/L.
查看习题详情和答案>>
海水
| 除去悬浮 |
| 杂质 |
| 浓缩 |
| 氯化剂 |
| 氯化 |
| 热空气 |
| Na2CO3溶液 |
| 吸收 |
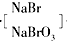
| H2SO4 |
(1)取24L除去悬浮杂质后的海水,浓缩至2L;
(2)向其中通入足量Cl2,反应的离子方程式: ,通入热空气的目的: ;
(3)将吹出的Br2用纯碱溶液吸收,反应得到NaBr、NaBrO3和CO2,反应的化学方程式: ,产生的CO2通入足量澄清石灰水中,得到1g白色沉淀;
(4)将吸收Br2的溶液用足量硫酸处理得到Br2单质,反应的化学方程式: ,理论上可以得到Br2的质量为 ;
(5)请计算海水中溴的浓度为 g/L.
某化学研究性学习小组在实验室中模拟海水提取溴的过程,其实验流程如下:
海水


 Br2(g)
Br2(g)

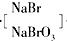
 Br2
Br2
(1)取24L除去悬浮杂质后的海水,浓缩至2L;
(2)向其中通入足量Cl2,反应的离子方程式:______,通入热空气的目的:______;
(3)将吹出的Br2用纯碱溶液吸收,反应得到NaBr、NaBrO3和CO2,反应的化学方程式:______,产生的CO2通入足量澄清石灰水中,得到1g白色沉淀;
(4)将吸收Br2的溶液用足量硫酸处理得到Br2单质,反应的化学方程式:______,理论上可以得到Br2的质量为______;
(5)请计算海水中溴的浓度为______g/L.
查看习题详情和答案>>
海水



 Br2(g)
Br2(g)
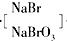
 Br2
Br2(1)取24L除去悬浮杂质后的海水,浓缩至2L;
(2)向其中通入足量Cl2,反应的离子方程式:______,通入热空气的目的:______;
(3)将吹出的Br2用纯碱溶液吸收,反应得到NaBr、NaBrO3和CO2,反应的化学方程式:______,产生的CO2通入足量澄清石灰水中,得到1g白色沉淀;
(4)将吸收Br2的溶液用足量硫酸处理得到Br2单质,反应的化学方程式:______,理论上可以得到Br2的质量为______;
(5)请计算海水中溴的浓度为______g/L.
查看习题详情和答案>>
某化学研究性学习小组在实验室中模拟海水提取溴的过程,其实验流程如下:
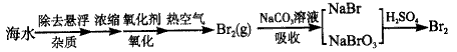
(1)取24 L除去悬浮杂质后的海水,浓缩至2L;
(2)向其中通入足量Cl2,反应的离子方程式:___________ ,通入热空气的目的:____________;
(3)将吹出的Br2用纯碱溶液吸收,反应得到NaBr、 NaBrO3和CO2,反应的化学方程式:_____________,产生的CO2通入足量澄清石灰水中,得到1g白色沉淀;
(4)将吸收Br2的溶液用足量硫酸处理得到Br2单质,反应的化学方程式:_______________,理论上可以得到Br2的质量为_____________;
(5)请计算海水中溴的浓度为____________g/L。
查看习题详情和答案>>
(2)向其中通入足量Cl2,反应的离子方程式:___________ ,通入热空气的目的:____________;
(3)将吹出的Br2用纯碱溶液吸收,反应得到NaBr、 NaBrO3和CO2,反应的化学方程式:_____________,产生的CO2通入足量澄清石灰水中,得到1g白色沉淀;
(4)将吸收Br2的溶液用足量硫酸处理得到Br2单质,反应的化学方程式:_______________,理论上可以得到Br2的质量为_____________;
(5)请计算海水中溴的浓度为____________g/L。
某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示。同学们根据中学化学知识,对该试剂的成分进行了一系列猜想和探究。
(1)同学们首先排除了试剂的成分是硫酸铜、硫酸铁、硫酸亚铁等的可能,理由是 _______ ___。
(2)取出少量溶液置于试管中,向其中滴入石蕊试液,石蕊试液呈现红色,同学们认为可以排除硫酸钠、硫酸钾等,理由是_______ _______________;但是不能排除是硫酸铵的可能性,其原因是(用离子方程式表示)____ ____。
(3)另取出少量溶液置于试管中,向其中加入锌粒,有大量无色气泡快速冒出。根据此现象,可推测溶质可能是下列物质中的__________________(填字母代号),生成气体的有关反应的离子方程式为_________ _________________________ 。
A.NaHSO4 B.(NH4)2SO4 C.MgSO4 D.H2SO4 E.Al2 (SO4)3
