网址:http://m.1010jiajiao.com/timu3_id_72782[举报]
 373 K时,某1 L密闭容器中发生如下可逆反应:A (g)
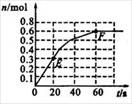
373 K时,某1 L密闭容器中发生如下可逆反应:A (g)2B (g)。其中物质B的物质的量变化如右图所示。
(1)已知373 K时60 s达到平衡,则前60s内A的平均反应速率为 。
(2)该反应的平衡常数表达式为 。
(3)若在此平衡体系中再加入amol的A,反应速率
(填“增大”或“减小”,下同),平衡时A的转化率 。A的平衡浓度 。
(4)若373 K时B的平衡浓度为A的2倍,473 K时(其他条件不变),B的平衡浓度为A的3倍,该反应的正反应为 (填“放热反应”或 “吸热反应”),为使该反应的平衡常数变小,可以采取的措施是 。
a.升高温度 b.扩大容器的体积
c.降低温度 d.将B从体系中抽走
(4)若反应在373K进行,在甲、乙两容器都为1 L密闭容器,分别加入1 mol B;1 mol B、0.2 mol He,达到平衡时B的转化率应 。
a.甲>乙 b.乙>甲 c.甲=乙 d.无法确定
查看习题详情和答案>>
 373 K时,某1 L密闭容器中发生如下可逆反应:A (g)
373 K时,某1 L密闭容器中发生如下可逆反应:A (g) 2B (g)。其中物质B的物质的量变化如右图所示。
2B (g)。其中物质B的物质的量变化如右图所示。
(1)已知373 K时60 s达到平衡,则前60 s内A的平均反应速率为 。
(2)该反应的平衡常数表达式为 。
(3)若在此平衡体系中再加入amol的A,反应速率
(填“增大”或“减小”,下同),平衡时A的转化率 。A的平衡浓度 。
(4)若373 K时B的平衡浓度为A的2倍,473 K时(其他条件不变),B的平衡浓度为A的3倍,该反应的正反应为 (填“放热反应”或 “吸热反应”),为使该反应的平衡常数变小,可以采取的措施是 。
a.升高温度 b.扩大容器的体积
c.降低温度 d.将B从体系中抽走
(4)若反应在373 K进行,在甲、乙两容器都为1 L密闭容器,分别加入1 mol B;1 mol B、0.2 mol He,达到平衡时B的转化率应 。
a.甲>乙 b.乙>甲 c.甲=乙 d.无法确定
查看习题详情和答案>>
373 K时,某1 L密闭容器中发生如下可逆反应:
A(g)![]() 2B(g).其中物质B的物质的量变化如下图所示
2B(g).其中物质B的物质的量变化如下图所示
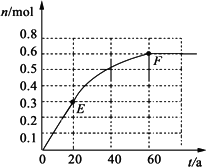
(1)已知373 K时60 s达到平衡,则前60 s内A的平均反应速率为________.
(2)该反应的平衡常数表达式为________.
(3)若在此平衡体系中再加入amol的A,反应速率________(填“增大”或“减小”,下同),平衡时A的转化率________.A的平衡浓度________.
(4)若373 K时B的平衡浓度为A的2倍,473 K时(其他条件不变),B的平衡浓度为A的3倍,该反应的正反应为________(填“放热反应”或“吸热反应”),为使该反应的平衡常数变小,可以采取的措施是________.
a.升高温度
b.扩大容器的体积
c.降低温度
d.将B从体系中抽走
373 K时,某1 L密闭容器中加入1molPCl5发生如下可逆反应:
![]() PCl5 (g) PCl3(g) + Cl2 (g)。其中物质PCl3的物质的量变化如图所示。
PCl5 (g) PCl3(g) + Cl2 (g)。其中物质PCl3的物质的量变化如图所示。

(1)前20 s内PCl5(g)的平均反应速率为
(2)373 K时该反应的平衡常数的值为
(3)若在此平衡体系中再加入1mol的PCl5,与原平衡比较,新平衡时PCl5的转化率 (填“增大”或“减小”,下同)。PCl5的平衡浓度
(4)将原平衡升温至473 K,重新达平衡时(其他条件不变),PCl3的平衡浓度为PCl5的3倍,该反应的正反应为 (填“放热反应”或 “吸热反应”),为增大平衡体系中Cl2的物质的量,下列措施正确的是(其它条件相同)
a.升高温度 b.扩大容器的体积
c.加入合适的催化剂 d.再充入PCl3
查看习题详情和答案>>(16分) 373 K时,某1 L密闭容器中加入1molPCl5发生如下可逆反应:
![]() PCl5 (g) PCl3(g) + Cl2 (g)。其中物质PCl3的物质的量变化如图所示。
PCl5 (g) PCl3(g) + Cl2 (g)。其中物质PCl3的物质的量变化如图所示。
(1)前20 s内PCl5(g)的平均反应速率为
(2)373 K时该反应的平衡常数的值为
(3)若在此平衡体系中再加入1mol的PCl5,与原平衡比较,新平衡时PCl5的转化率 (填“增大”或“减小”,下同)。PCl5的平衡浓度
(4)将原平衡升温至473 K,重新达平衡时(其他条件不变),PCl3的平衡浓度为PCl5的3倍,该反应的正反应为 (填“放热反应”或 “吸热反应”),为增大平衡体系中Cl2的物质的量,下列措施正确的是(其它条件相同)
a.升高温度 b.扩大容器的体积
c.加入合适的催化剂 d.再充入PCl3
查看习题详情和答案>>