摘要:5.分析如图所示的四个原电池装置.其中结论正确的是 ( ) A.①②中Mg作为负极.③④中Fe作为负极 B.②中Mg作为正极.电极反应式为6H2O+6e-===6OH-+3H2↑ C.③中Fe作为负极.电极反应式为Fe-2e-===Fe2+ D.④中Cu作为正极.电极反应式为2H++2e-===H2↑ 解析:Mg比Al活泼.在①中Mg做负极.但在NaOH溶液中.Mg不反应.而Al可以反应.故②中Al是负极.在浓HNO3中铁会钝化.故Cu为负极.Fe为正极.在④中由于不断向Cu极附近通入空气.而O2比溶液中的H+得e-能力强.故Fe失去的电子.在Cu极被O2得到.电极反应式为:O2+2H2O+4e-===4OH-. 答案:B
网址:http://m.1010jiajiao.com/timu3_id_72707[举报]
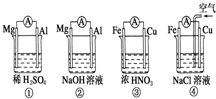
分析如图所示的四个原电池装置,其中结论正确的是 ( )

A.①②中Mg作为负极,③④中Fe作为负极
B.②中Mg作为正极,电极反应式为6H2O+6e- ===6OH-+3H2↑
C.③中Fe作为负极,电极反应为Fe-2e-===Fe2+
D.④中Cu作为正极,电极反应式为2H++2e-===H2↑
查看习题详情和答案>>
分析如图所示的四个原电池装置,其中结论正确的是( )
查看习题详情和答案>>
| A.①②中Mg作为负极,③④中Fe作为负极 |
| B.②中Mg作为正极,电极反应式为6H2O+6e-═6OH-+3H2↑ |
| C.③中Fe作为负极,电极反应为Fe-2e-═Fe2+ |
| D.④中Cu作为正极,电极反应式为2H++2e-═H2↑ |

 分析如图所示的四个原电池装置,其中结论正确的是( )
分析如图所示的四个原电池装置,其中结论正确的是( )
