摘要:17.下列反应中.不属于氧化还原反应的是 A.2+222 B.H4+222+2H2 .2l3 2l+32↑ D.2Fe(H)3Fe23 +3H2
网址:http://m.1010jiajiao.com/timu3_id_72502[举报]
下列反应中,不属于氧化还原反应的是( )
A、2Na+O2
| ||||
B、3CO+Fe2O3
| ||||
C、2H2O2
| ||||
| D、Ca(OH)2+NaOH═CaCO3↓+2NaOH |
下列叙述不正确的是( )
①NH3易液化,液氨常用作制冷剂②与金属反应时,稀HNO3被还原为NO,而浓HNO3被还原为NO2,故稀HNO3的氧化性强于浓HNO3③氨盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉处④稀HNO3与活泼金属反应时一定生成NO⑤光导纤维的主要成份是SiO2⑥酸酐一定能与水反应生成对应的酸⑦二氧化硫和氯气以2:1比例混合通入石蕊溶液中,溶液一定呈红色⑧硅胶用作干燥剂、吸附剂、催化剂载体⑨NH3的水溶液能导电所以NH3是电解质,液态HCl不能导电所以HCl是非电解质.
①NH3易液化,液氨常用作制冷剂②与金属反应时,稀HNO3被还原为NO,而浓HNO3被还原为NO2,故稀HNO3的氧化性强于浓HNO3③氨盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉处④稀HNO3与活泼金属反应时一定生成NO⑤光导纤维的主要成份是SiO2⑥酸酐一定能与水反应生成对应的酸⑦二氧化硫和氯气以2:1比例混合通入石蕊溶液中,溶液一定呈红色⑧硅胶用作干燥剂、吸附剂、催化剂载体⑨NH3的水溶液能导电所以NH3是电解质,液态HCl不能导电所以HCl是非电解质.
查看习题详情和答案>>
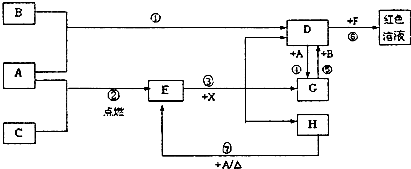
A、B、C、D、E、F是周期表前30号元素中的六种元素,它们的原子序数依次增大,三种为金属元素、三种为非金属元素.常温下,A、E两种元素所形成的常见单质为气体,B、C、D、F四种元素所形成的常见单质为固体,实验室通常将B单质保存在煤油中,单质B与单质A因反应条件不同生成两种不同的化合物甲和乙.C和E元素的原子均只有一个未成对P电子.D和F两元素形成的某种化合物是硫酸工业的常用原料.
回答下列问题:
(1)F元素在周期表中的位置为
(2)甲、乙均能与水反应,但甲与水发生的反应属于氧化还原反应,写出甲的电子式
 ,写出甲与水发生反应的化学方程式并标出电子转移的方向和数目:
,写出甲与水发生反应的化学方程式并标出电子转移的方向和数目:
 .
.
(3)F的一种红褐色氢氧化物与E的单质、B的最高价氧化物对应的水化物三种物质作用可生成一种净水剂B2FA4,试写出该反应的化学反应方程式为:
查看习题详情和答案>>
回答下列问题:
(1)F元素在周期表中的位置为
第四周期第VIII族
第四周期第VIII族
,F原子基态时核外电子排布式1s22s22p43s23p43d44s2
1s22s22p43s23p43d44s2
.(2)甲、乙均能与水反应,但甲与水发生的反应属于氧化还原反应,写出甲的电子式




(3)F的一种红褐色氢氧化物与E的单质、B的最高价氧化物对应的水化物三种物质作用可生成一种净水剂B2FA4,试写出该反应的化学反应方程式为:
2Fe(OH)3+10NaOH+3Cl2=2Na2FeO4+6NaCl+8H2O
2Fe(OH)3+10NaOH+3Cl2=2Na2FeO4+6NaCl+8H2O
.A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是所有原子中半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的
,A、B、D、E这四种元素中,每一种都与C元素形成原子个数比不相同的化合物.
请回答下列问题:
(l)C和E两元素相比较,非金属性较强的是
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的单质在常温下的状态
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)B元素的氢化物在催化剂存在的情况下与C元素单质反应的化学方程式为
(3)C、D两元素形成的原子个数比为1:1的化合物,E、C两元素形成的原子个数比为1:2的化合物,该两种化合物反应的化学方程式为
(4)A、C、D、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为
(5)A与C、A与E可分别形成甲、乙两种负一价双原子离子,且甲有10个电子,乙有18个电子,则甲与乙反应的离子方程式为
(6)B元素的气态氢化物却其一种常见氧化物(双原于分子)能反应生成B的单质,该反应中氧化产物与还原产物的物质的量之比为
查看习题详情和答案>>
| 3 |
| 4 |
请回答下列问题:
(l)C和E两元素相比较,非金属性较强的是
氧
氧
(填“元素名称”),可以验证该结论的是CD
CD
(填“序号”).A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的单质在常温下的状态
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)B元素的氢化物在催化剂存在的情况下与C元素单质反应的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(3)C、D两元素形成的原子个数比为1:1的化合物,E、C两元素形成的原子个数比为1:2的化合物,该两种化合物反应的化学方程式为
Na2O2+SO2═Na2SO4
Na2O2+SO2═Na2SO4
.(4)A、C、D、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为
HSO3-+H+═SO2↑+H2O
HSO3-+H+═SO2↑+H2O
.(5)A与C、A与E可分别形成甲、乙两种负一价双原子离子,且甲有10个电子,乙有18个电子,则甲与乙反应的离子方程式为
HS-+OH-═S2-+H2O
HS-+OH-═S2-+H2O
.(6)B元素的气态氢化物却其一种常见氧化物(双原于分子)能反应生成B的单质,该反应中氧化产物与还原产物的物质的量之比为
2:3
2:3
.