摘要:(1)2Mn4-+242-+16H+==2Mn2++8H2+102↑ (2) 242- ~ 2Mn4- 2
网址:http://m.1010jiajiao.com/timu3_id_72389[举报]
| 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Ql、Q2均为正值) H2(g)+Cl2→2HCl(g)  H=-Q1 H2(g)+Br2(g)→2HBr(g) H=-Q1 H2(g)+Br2(g)→2HBr(g) H=-Q2 H=-Q2有关上述反应的叙述正确的是( )
|
查看习题详情和答案>>
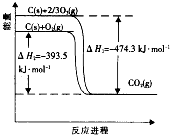 碳在氧气或臭氧中燃烧的能量变化如图.下列说法不正确的是( )
碳在氧气或臭氧中燃烧的能量变化如图.下列说法不正确的是( )| A、3O2(g)=2O3(g)△H=+242.4kJ?mol-1 | B、氧气比臭氧稳定,大气中臭氧层易被破坏 | C、若火电厂用臭氧燃烧煤有利于获得更多的电能 | D、断裂l mol O2(g)中的共价键吸收的能量比形成1 molCO2(g)中的共价键放出的能量少 |
工业上常用天然气作为制备CH3OH的原料.已知:
①CH4(g)+O2(g)?CO(g)+H2(g)+H2O(g)△H=-321.5kJ/mol
②CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+250.3kJ/mol
③CO(g)+2H2(g)?CH3OH(g)△H=-90.0kJ/mol
(1)CH4(g)与O2(g)反应生成CH3OH(g)的热化学方程式为
(2)向VL恒容密闭容器中充入a mol CO与2a mol H2,在不同压强下合成甲醇.CO的平衡转化率与温度、压强的关系如图1所示:
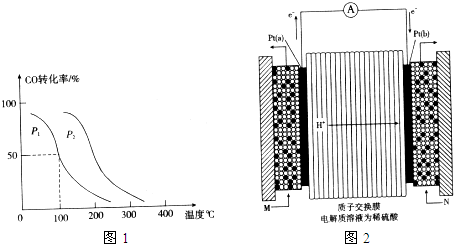
①压强P1
②在100℃、P1压强时,平衡常数为
(3)如图2所示是甲醇燃料电池(电解质溶液为稀硫酸)结构示意图,Pt(a)电极通入的M为
查看习题详情和答案>>
①CH4(g)+O2(g)?CO(g)+H2(g)+H2O(g)△H=-321.5kJ/mol
②CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+250.3kJ/mol
③CO(g)+2H2(g)?CH3OH(g)△H=-90.0kJ/mol
(1)CH4(g)与O2(g)反应生成CH3OH(g)的热化学方程式为
2CH4(g)+O2(g)=2CH3OH(g)△H=-251.2KJ/mol
2CH4(g)+O2(g)=2CH3OH(g)△H=-251.2KJ/mol
.(2)向VL恒容密闭容器中充入a mol CO与2a mol H2,在不同压强下合成甲醇.CO的平衡转化率与温度、压强的关系如图1所示:

①压强P1
<
<
P2(填“<”、“>”或“=”)②在100℃、P1压强时,平衡常数为
2×
| V2 |
| a2 |
2×
(用含a、V的代数式表示).| V2 |
| a2 |
(3)如图2所示是甲醇燃料电池(电解质溶液为稀硫酸)结构示意图,Pt(a)电极通入的M为
甲醇
甲醇
,电极反应式是CH3OH-6e-+H2O=CO2+6H+
CH3OH-6e-+H2O=CO2+6H+
.若用该电池电解CuSO4溶液,当得到3.2g铜时,参加反应的气体N的体积应为2.24
2.24
L(标准状况).
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
C+ K2Cr2O7+ → CO2↑+ K2SO4+ Cr2(SO4)3+ H2O
请完成并配平上述化学方程式.
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
①下列措施中有利于增大该反应的反应速率的是 ;
A、随时将CH3OH与反应混合物分离
B、降低反应温度
C、增大体系压强
D、使用高效催化剂
②已知:CO(g)+
O2(g)=CO2(g)△H2=-283 kJ?mol-1H2(g)+
O2(g)=H2O(g)△H3=-242 kJ?mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为 ;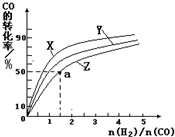
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是 ;
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g) 的平衡常数K= .
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 .
查看习题详情和答案>>
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
请完成并配平上述化学方程式.
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
①下列措施中有利于增大该反应的反应速率的是
A、随时将CH3OH与反应混合物分离
B、降低反应温度
C、增大体系压强
D、使用高效催化剂
②已知:CO(g)+
| 1 |
| 2 |
| 1 |
| 2 |
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为

③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g) 的平衡常数K=
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
(1)0.5molO3中含有的分子数是
(2)将4gNaOH溶于
(3)将下列残缺的离子方程式补充完整,然后写出一个相应的化学方程式.
Cu(OH)2+
(4)下列物质能导电的是
①水银 ②烧碱 ③干冰 ④氯化钠晶体 ⑤盐酸溶液 ⑥蔗糖
(5)在标准状况下,1.7g氨气所占的体积为
查看习题详情和答案>>
0.5NA
0.5NA
个,原子数是1.5NA
1.5NA
个,质子数是12NA
12NA
个.(2)将4gNaOH溶于
180
180
克水中,才能使每100个H2O分子溶有一个Na+.(3)将下列残缺的离子方程式补充完整,然后写出一个相应的化学方程式.
Cu(OH)2+
2H+
2H+
=Cu2++2H2O
2H2O
(4)下列物质能导电的是
①⑤
①⑤
,属于电解质的是②④
②④
,属于非电解质的是③⑥
③⑥
.①水银 ②烧碱 ③干冰 ④氯化钠晶体 ⑤盐酸溶液 ⑥蔗糖
(5)在标准状况下,1.7g氨气所占的体积为
2.24
2.24
L,它与标准状况下3.36
3.36
L的硫化氢(H2S)含有相同数目的氢原子.