网址:http://m.1010jiajiao.com/timu3_id_72119[举报]
(8分)往100 mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入的CO2的体积V(标准状况)与M的质量W的关系如下图所示。试解答下列问题: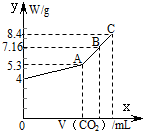
(1)A点时,白色固体M的化学式为____________________,通入的CO2的体积为________ mL(标准状况下,下同)。
(2)C点时,白色固体M的化学式为____________________,通入的CO2的体积为________ mL。
(3)B点时M的组成成分为________(用化学式表示),通入的CO2的体积为________ mL。
(4)该NaOH溶液的物质的量浓度为________。
往100 mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M.通入的CO2的体积V(标准状况)与M的质量W的关系如下图所示.试解答下列问题:
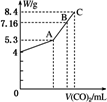
(1)A点时,白色固体M的化学式为________,通入的CO2的体积为________ mL(标准状况下,下同).
(2)C点时,白色固体M的化学式为________,通入的CO2的体积为________mL.
(3)B点时M的组成成分为________(用化学式表示),通入的CO2的体积为________mL.
(4)该NaOH溶液的物质的量浓度为________.
往100 mL NaOH溶液中通入CO2充分反应后,在低压和较低温度下,小心将溶液蒸干,得白色固体M.通入CO2的体积V(CO2)mL(标准状况下,下同)与M的质量W(g)的关系如图所示.(已知标准状况下44 g二氧化碳体积22400 mL)
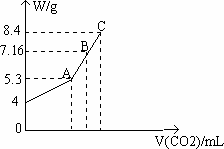
(1)A点时,白色固体M的化学式为________,通入CO2的体积为________mL.(只填结果,不要求计算过程)
(2)C点时,白色固体M的化学式为________,通入CO2的体积为________mL.(只填结果,不要求计算过程)
(3)推算B点时M的组成(用化学式表示)及通入CO2气体体积.
(10分)有人设计出一种在隔绝空气下让钠与水反应的方法,利用煤油来控制反应速率。使学生能仔细观察到各种实验现象。该方法简便、安全、现象明显、有趣味性。实验装置如图所示,将规格为6×55 mm玻璃管和长颈漏斗插入橡皮孔中,玻璃管外套上30 mm的乳胶管,乳胶管上再接规格为6×30 mm金属尖嘴管,乳胶管上夹上弹簧夹。
实验时,往100 mL的大试管中先加入40 mL煤油,取2粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过漏斗加满滴有酚酞的水。根据反应中观察到的现象,回答下列问题。

根据反应中观察到的现象,回答下列问题:
(1)金属钠变化的现象是_____________
。
(2)大试管中溶液颜色的变化是_____ __________。
(3)装置中液面的变化分别是:
大试管中_________ ;
长颈漏斗中______________ __。
(4)简述检验产生的气体的方法:_____ _________________。
查看习题详情和答案>>
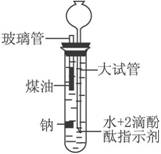
如上图所示将6 mm×50 mm的玻璃管和长颈漏斗插入橡皮塞孔中,玻璃管外套上30 mm的乳胶管,乳胶管上再接6 mm×30 mm金属尖嘴管,乳胶管上夹上弹簧夹。
实验时,往100 mL的大试管中先加入40 mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过漏斗加满滴有酚酞的水。根据反应中观察到的现象,回答下列问题。
(1)金属钠变化的现象是____________。
(2)大试管中溶液颜色的变化是____________。
(3)装置中液面的变化分别是:大试管_________;长颈漏斗中____________。
(4)简述检验产生气体的方法:________________________。
查看习题详情和答案>>