摘要:2.Mg + 2HCl =MgCl2 + H2 ↑ 2Al + 6 HCl = 2AlCl3 +3H2 ↑ 金属性:Mg > Al 根据1.2得出结论 : Na Mg Al 金属性逐渐减弱
网址:http://m.1010jiajiao.com/timu3_id_71215[举报]
下列反应中,HCl作为还原剂的是
- A.Ca(OH)2+2HCl=CaCl2+2H2O
- B.CaCO3+2HCl=CaCl2+CO2↑+H2O
- C.Mg+2HCl=MgCl2+H2↑
- D.MnO2+4HCl=MnCl2+Cl2↑+2H2O
向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入c mol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系正确的是
A. B.
B.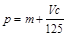 C.n=m+17Vc
D.
C.n=m+17Vc
D. <p<
<p<
查看习题详情和答案>>
向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是
A.c=1000b/11.2V B.p=m+Vc/125 C.n=m+17Vc D.5/3m<p<17/9m
查看习题详情和答案>>
(每空1分,共6分)下面是某科学兴趣小组的同学做同周期元素性质递变规律实验时,设计的一套实验方案。其中实验步骤如下:
请整理并完成实验报告:
(1)实验目的: 。
(2)实验用品:
试剂:金属钠、镁条、铝条、稀盐酸、新制氯水、新制Na2S溶液、AlCl3溶液、NaOH溶液等。
仪器: 、酒精灯、表面皿、试管夹、镊子、小刀、玻璃片、砂纸等。
(3)实验内容(完成下列表格中的未完成的实验现象和化学方程式):
| 实验序号 | 实验现象 | 化学方程式 |
| ① | 有气体产生,溶液变成浅红色 | |
| ② | 生成浅黄色沉淀 | Na2S+Cl2=2NaCl+S↓ |
| ③ | | 2Na+2H2O=2NaOH+H2↑ |
| ④ | 剧烈反应,迅速产生无色气体 | Mg+2HCl=MgCl2+H2↑ |
| ⑤ | 反应不十分剧烈,产生无色气体 | 2Al+6HCl=2AlCl3+3H2↑ |
| ⑥ | 开始时生成白色胶状沉淀,继而沉淀消失 | AlCl3+3NaOH=Al(OH)3↓+3NaCl Al(OH)3+NaOH=NaAlO2+2H2O |
(5)请用原子结构的知识简单解释上述结论: 。 查看习题详情和答案>>
下列反应中,可用离子方程式H++OH-=H2O表示的是
A.NH4Cl+NaOH NaCl+NH3↑+H2O NaCl+NH3↑+H2O | B.NaOH+HNO3=NaNO3+H2O |
| C.Mg(OH)2+2HCl=MgCl2+2H2O | D.NaOH +NaHCO2=NaHCO3+H2O |