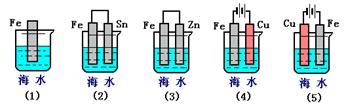
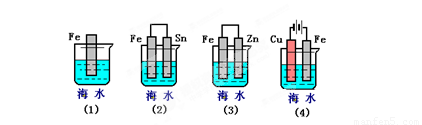
摘要:(09-10·福建厦门理工学院附中高二下期中)下列各情况.在其中Fe片腐蚀由快到慢的顺序是 答案:⑸⑵⑴⑶⑷
网址:http://m.1010jiajiao.com/timu3_id_71004[举报]
 写出下列反应的热化学方程式.
写出下列反应的热化学方程式.(1)25℃,1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出表示硫燃烧生成1molSO2的热化学方程式
S(s)+O2(g)=SO2(g)△H=-299.52 kJ?mol-1
S(s)+O2(g)=SO2(g)△H=-299.52 kJ?mol-1
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ/mol
H2(g)+1/2O2(g)=H2O(l)△H=-285.84kJ/mol 在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol
Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol
.(3)下列各情况,在其中Fe片腐蚀由快到慢的顺序是
④②①③
④②①③
(填序号)
写出下列反应的热化学方程式.
(1)25℃,1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出表示硫燃烧生成1molSO2的热化学方程式
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ/mol
H2(g)+
O2(g)=H2O(l)△H=-285.84kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 .
(3)下列各情况,在其中Fe片腐蚀由快到慢的顺序是 (填序号)
 查看习题详情和答案>>
查看习题详情和答案>>
(1)25℃,1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出表示硫燃烧生成1molSO2的热化学方程式
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ/mol
H2(g)+
| 1 | 2 |
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
(3)下列各情况,在其中Fe片腐蚀由快到慢的顺序是
 查看习题详情和答案>>
查看习题详情和答案>>
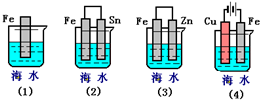 下列各情况,在其中Fe片腐蚀由快到慢的顺序是
下列各情况,在其中Fe片腐蚀由快到慢的顺序是