摘要:2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如右图所示.已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mo-1L.请回答下列问题: (1)图中A.C分别表示 . .E的大小对该反应的反应热有无影响? .该反应通常用V2O5作催化剂.加V2O5会使图中B点升高还是降低? .理由是 . (2)图中ΔH= kJ·mo-1L. (3)V2O5的催化循环机理可能为:V2O5氧化SO2时.自身被还原为四价钒化合物,四价钒化合物再被氧气氧化.写出该催化循环机理的化学方程式 . (4)如果反应速率v(SO2)为0.05 mol·-1L·miN-1.则v(O2)= mol·-1L·miN-1.v(SO3)= mol·-1L·miN-1.(5)已知单质硫的燃烧热为296 kJ·mo-1L.计算由S(s)生成3 mol SO3(g)的ΔH .
网址:http://m.1010jiajiao.com/timu3_id_70529[举报]
金属钛(Ti)被誉为“未来金属”.常温时耐酸碱腐蚀而被广泛应用.以含有杂质Fe2O3的钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼钛同时获得副产品甲的生产流程如下:
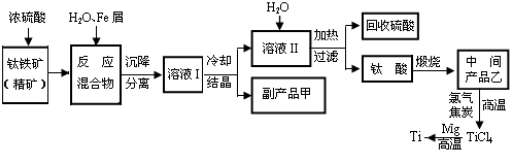
回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成.副产品甲是 .写出该物质的一种用途: .
(2)用TiCl4制备乙:TiCl4+(x+2)H2O?乙?x H2O↓+4HCl,制备时为了促进水解趋于完全,采取的措施: .
(3)用钛铁矿与氢气反应也可生产乙和水,写出该反应的化学方程式: ;该反应的还原产物是: .
(4)已知:
①C(s)+O2(g)=CO2(g);△H=-393.5kJ?mol-1
②2CO(g)+O2(g)=2CO2(g);△H=-566kJ?mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ?mol-1
则TiO2(S)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)△H= .
(5)此工艺需要大量浓硫酸,工业上用:2SO2+O2?2SO3生产硫酸.一定温度下密闭容器中,c(SO2)始=0.4mol/L c(O2)始=1mol/L,经测定反应在该温度下的平衡常数K≈19,试判断:当SO2转化率为50%时,反应 (填:是、否)达到平衡状态;若未达到,向 (填:正、逆)方向进行.
查看习题详情和答案>>

回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成.副产品甲是
(2)用TiCl4制备乙:TiCl4+(x+2)H2O?乙?x H2O↓+4HCl,制备时为了促进水解趋于完全,采取的措施:
(3)用钛铁矿与氢气反应也可生产乙和水,写出该反应的化学方程式:
(4)已知:
①C(s)+O2(g)=CO2(g);△H=-393.5kJ?mol-1
②2CO(g)+O2(g)=2CO2(g);△H=-566kJ?mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ?mol-1
则TiO2(S)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)△H=
(5)此工艺需要大量浓硫酸,工业上用:2SO2+O2?2SO3生产硫酸.一定温度下密闭容器中,c(SO2)始=0.4mol/L c(O2)始=1mol/L,经测定反应在该温度下的平衡常数K≈19,试判断:当SO2转化率为50%时,反应