摘要:2.溶液的pH计算 酸可直接计算.碱可通过pOH转换成pH. pH= -lg{c(H+)} .pOH= -lg{c(OH-)}.pKw=-lg{ Kw}. 25℃时.pH+pOH=14 例题1:相同温度.相同物质的量浓度的四种溶液:①CH3COONa②NaHSO4 ③NaCl ④C6H5-ONa.按pH由大到小的顺序排列.正确的是( ) A.④ > ① > ③ > ② B.① > ④ > ③ > ② C.① > ② > ③ > ④ D.④ > ③ > ① > ② 方法:溶液pH的大小由两种情况决定.一是电解质本身的电离.二是水的电离.而水的电离程度的大小又决定于盐类水解程度的大小.此类试题要求准确把握酸碱的相对强弱.充分依靠水解规律判析. 捷径:四种溶液可分成三组.②NaHSO4.电离显酸性.pH<7,③NaCl为强酸强碱的正盐.不水解.溶液呈中性.pH=7,①④是强碱弱酸盐.水溶液均呈碱性.因CH3COOH的酸性较C6H5OH强.故pH值应为④>①.以此得答案A.
网址:http://m.1010jiajiao.com/timu3_id_69557[举报]
燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池。氢气、烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料。请回答下列问题:
(I)以甲烷和氧气为原料,氢氧化钠溶液为电解质溶液构成电池。写出其正极电极反应式 。
(II)以上述电池为电源,石墨为电极电解1L 0. 1mol/L的氯化钾溶液。回答下列问题:
(1)写出电解总反应的离子方程式 。
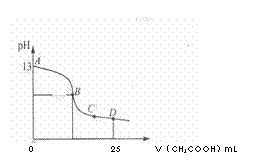
(2)室温时,电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸,加入醋酸的体积与溶液的pH的关系如图所示(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。
①计算消耗标准状况下甲烷 mL。
②若图中的B点pH=7,则酸碱恰好完全反应的点在 区间(填“AB”、“BC”或“CD”)。
③AB区间溶液中各离子浓度大小关系中可能正确的是 。
A. c(K+)>c(OH-)>c (CH3COO-) >c(H+)
B. c(K+)>c(CH3COO-)>c(OH-) >c(H+)
C. c(K+)>c(CH3COO-)=c(OH-) >c(H+)
查看习题详情和答案>>
下列叙述不正确的是:
A.用反应热数据的大小判断不同反应反应速率的快慢
B.用pH数据推测相同浓度的不同强酸弱碱盐在水溶液中水解程度的大小
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.用平衡常数的大小判断化学反应可能进行的程度
查看习题详情和答案>>
下列叙述不正确的是:
| A.用反应热数据的大小判断不同反应反应速率的快慢 |
| B.用pH数据推测相同浓度的不同强酸弱碱盐在水溶液中水解程度的大小 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.用平衡常数的大小判断化学反应可能进行的程度 |