摘要:化学结构理论知识点多.重要的内容:原子.分子和晶体结构.化学键理论.元素周期律理论等.物质结构.元素周期律是中学化学的基本理论之一.也是高考的必考内容之一.要求理解并熟记主族元素的原子结构.同周期.同主族元素的性质递变规律及元素周期表的结构.理解三者之间的内在联系.晶体的类型和性质等.在体现基础知识再现的同时.侧重于观察.分析.推理能力的考查.近年来.高考题中主要以元素推断题出现.旨在考查考生的分析推理能力.往往从学科前沿或社会热点立意命题.引导学生关注科技发展.关注社会热点.1.用原子半径.元素化合价周期性变化比较不同元素原子或离子半径大小
网址:http://m.1010jiajiao.com/timu3_id_69532[举报]
(共8分)(1) 越来越多的事实表明:在环境与生物体系中,元素的毒性、生物可给性、迁移性和再迁移性不是取决于元素的总量,而是与该元素的化学形态密切相关。例如,在天然水正常pH下,铝处于 形态,对鱼类是无毒的;但是,若天然水被酸雨酸化,铝则转化为可溶性有毒形态 ,会造成鱼类的大量死亡。再如,铝离子能穿过血脑屏障进入人脑组织,引起痴呆等严重后果,而配合态的铝,如处于 形态时就没有这种危险。
(2) 在元素周期表第4、第5周期中成单电子数最多的过渡元素的电子构型分别为 和 ;元素名称是 和 。依据现代原子结构理论,请你推测,当出现5g电子后,成单电子最多的元素可能的价层电子构型为 ,可能是 元素。
查看习题详情和答案>>(2009?湛江二模)在某个容积为2.0L的密闭容器中,在T℃时按下图1所示发生反应:
mA(g)+nB(g)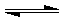 pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
(1)图1所示,反应开始至达到平衡时,用D表示的平均反应速率为
(2)T℃时该反应的化学平衡常数K的数值为
(3)反应达到平衡后,第6min时:
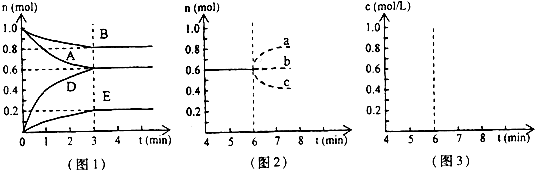
①若升高温度,D的物质的量变化曲线最可能的是
②若在6min时仍为原平衡,此时将容器的容积压缩为原来的一半.请在图3中画出6min后B浓度的变化曲线
 .
.
4)在T℃时,相同容器中,若开始时加入0.4molA、0.8molB、0.9molD和0.5molE0.5mol,反应达到平衡后,A的浓度范围为
(5)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产品产率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益.
查看习题详情和答案>>
mA(g)+nB(g)
 pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
(1)图1所示,反应开始至达到平衡时,用D表示的平均反应速率为
0.1mol/(L?min)
0.1mol/(L?min)
.(2)T℃时该反应的化学平衡常数K的数值为
0.75
0.75
.(3)反应达到平衡后,第6min时:
①若升高温度,D的物质的量变化曲线最可能的是
c
c
(用图2中的a~c的编号作答);②若在6min时仍为原平衡,此时将容器的容积压缩为原来的一半.请在图3中画出6min后B浓度的变化曲线


4)在T℃时,相同容器中,若开始时加入0.4molA、0.8molB、0.9molD和0.5molE0.5mol,反应达到平衡后,A的浓度范围为
0.2mol/L<c(A)<0.3mol/L
0.2mol/L<c(A)<0.3mol/L
.(5)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是
BD
BD
.A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产品产率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益.
如何利用实验室常见的药品试剂探究11号~17号元素的金属性逐渐减弱,非金属性逐渐增强?已知实验室有你想用到的仪器和药品、试纸等一切用品.
猜想与假设:(1)用
(2)因实验室不可能有硅单质,但可以测0.1mol/L的
(3)制取饱和的氯水和饱和的氢硫酸溶液,用将
设计和实施方案:(1)用列表的方式(从实验方案、实验现象、有关化学方程式)完成你的实验报告中的实验内容.
(2)实验结论是
(3)请你用物质结构理论知识解释结论.
查看习题详情和答案>>
猜想与假设:(1)用
钠、镁、铝
钠、镁、铝
三种金属分别与水反应,通过观察生成气泡的速率便会得出从钠
钠
到铝
铝
金属性逐渐减弱.(2)因实验室不可能有硅单质,但可以测0.1mol/L的
Na2SiO3
Na2SiO3
溶液和Na3PO4
Na3PO4
溶液及Na2SO4溶液的pH,推断三种盐溶液的水解情况,得出H2SiO3
H2SiO3
、H3PO4
H3PO4
、硫酸三种最高价含氧酸的酸性强弱顺序是H2SiO3<H3PO4<H2SO4
H2SiO3<H3PO4<H2SO4
,从而得出从Si
Si
到S
S
非金属性逐渐增强.(3)制取饱和的氯水和饱和的氢硫酸溶液,用将
饱和氯水滴加到饱和氢硫酸溶液中的
饱和氯水滴加到饱和氢硫酸溶液中的
方法,通过溶液中有浅黄色沉淀生成
溶液中有浅黄色沉淀生成
现象便直接得出非金属性S比Cl弱.设计和实施方案:(1)用列表的方式(从实验方案、实验现象、有关化学方程式)完成你的实验报告中的实验内容.
(2)实验结论是
金属性:Na>Mg>Al,非金属性:Si<P<S<Cl
金属性:Na>Mg>Al,非金属性:Si<P<S<Cl
.(3)请你用物质结构理论知识解释结论.
 【化学--物质结构与性质】
【化学--物质结构与性质】物质结构理论有助于人们理解物质变化的本质,进行分子设计和研究反应规律.请回答下列问题:
(1)第三周期基态原子有2个未成对电子且电负性最大的元素是
(2)金属晶体受到外力作用时易发生形变,而离子晶体容易破裂.试从结构的角度分析其中的主要原因
(3)已知在水中存在平衡2H2O?H3O++OH-.下列分子中,中心原子采取的杂化方式与H3O+中氧原子的杂化方式相同的是
a.CH2═CH2中的碳原子 b.NH
- 2 |
- 3 |
- 2 |
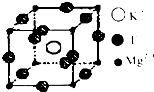
(4)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中Mg元素的质量分数为