摘要:3.25℃恒温条件下.将固体物质A的溶液200g蒸发20g水后.析出10gA,再蒸发20g水.又析出20gA.则蒸发前的溶液中溶质的质量分数是多少? 例3.有一种只含SiO2杂质(SiO2不溶于水.也不与盐酸反应)的石灰石样品.某学生想测定该样品中碳酸钙的质量分数.他取用2g样品.把16g稀盐酸平均分4次加入.充分反应后剩余固体的质量依次记录于下表: 计算:(1)样品中碳酸钙的质量分数. (2)2g样品与稀盐酸充分反应时.恰好用去稀盐酸的质量为多少克?此时.所得溶液溶质的质量分数为多少? 巩固练习: 用相同质量的铁和锌跟一定量的稀硫酸反应.其反应过程如下图所示(图中横.纵坐标分别表示反应的时间t和产生氢气的质量m).试回答: (1)曲线A表示的是跟稀硫酸反应的情况 , (2)上述曲线图除能说明(1)的结论外.还可以得出另外两个结论.它们是 . . 拓展提高:
网址:http://m.1010jiajiao.com/timu3_id_6901[举报]
25、石笋和钟乳石的形成过程中会发生如下两个反应:
CaCO3+CO2+H2O=Ca(HCO3)2 (a) Ca(HCO3)2=CaCO3↓+CO2↑+H2O (b)
下图中,A为单质,常温常压下C为气体,固态时可用于人工降雨.D溶液为浅绿色,G是发酵粉的主要成分之一.F G、G F的反应分别类似上述反应a与b.(部分产物略去)
(1)推断:G的俗名是
(2)A在氧气中燃烧的现象是
(3)比较反应b与反应⑧,推测反应b发生时的条件为
(4)写化学方程式:反应③
(5)将x露置在空气中,其质量会
(6)总结反应⑤、⑨、⑩的特点,可得出的结论是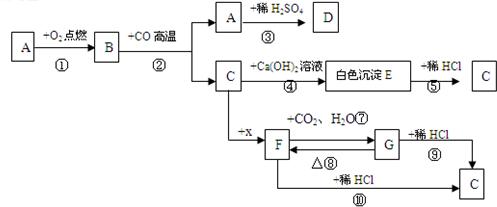
查看习题详情和答案>>
CaCO3+CO2+H2O=Ca(HCO3)2 (a) Ca(HCO3)2=CaCO3↓+CO2↑+H2O (b)
下图中,A为单质,常温常压下C为气体,固态时可用于人工降雨.D溶液为浅绿色,G是发酵粉的主要成分之一.F G、G F的反应分别类似上述反应a与b.(部分产物略去)
(1)推断:G的俗名是
小苏打
;x的化学式是NaOH
;(2)A在氧气中燃烧的现象是
火星四射、发出耀眼的强光
;(3)比较反应b与反应⑧,推测反应b发生时的条件为
加热
;(4)写化学方程式:反应③
Fe+H2SO4=FeSO4+H2↑
;反应④CO2+Ca(OH)2=CaCO3↓+H2O
.(5)将x露置在空气中,其质量会
增大
(填“增大”、“减小”或“不变”);该现象是否符合质量守恒定律?符合
(填“符合”或“不符合”);(6)总结反应⑤、⑨、⑩的特点,可得出的结论是
碳酸盐与酸反应均产生CO2
.