网址:http://m.1010jiajiao.com/timu3_id_68965[举报]
| c(H+) |
| c(OH-) |
(1)HA是
(2)在加水稀释HA的过程中,随着水量的增加而减小的是
A.
| c(H+) |
| c(HA) |
| c(HA) |
| c(A-) |
(3)向等体积、等pH的HA溶液和盐酸中分别加入足量Zn,产生的H2
A.HA多 B.盐酸多 C.二者一样多 D.无法判断
(4)将该HA溶液和0.1mol/LNaOH溶液按不同体积混合,所得混合溶液的pH如下表:
| 实验编号 | HA溶液体积(mL) | NaOH溶液体积(mL) | 混合溶液的pH |
| 甲 | 20.00 | 20.00 | a |
| 乙 | 20.00 | V | 7 |
| 丙 | 20.00 | 10.00 | <7 |
a
②用离子方程式表示甲组混合液pH=a的原因
③乙组混合液中各种离子浓度大小关系为
(15分)(1)25℃时,0.1 mol·L-1的HA溶液中c(H+)/c(OH-)=1010。请回答下列问题:
①HA是________(填“强电解质”或“弱电解质”);
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是________(填字母)。
A.c(H+)/c(HA) B.c(HA)/(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
③若M溶液是由上述HA溶液V1 mL与pH = 12的NaOH溶液V2 mL混合充分反应而得,则下列说法中正确的是
A.若溶液M呈中性,则溶液M中c(H+) + c(OH-) = 2.0×10-7 mol·L-1
B.若V1 =V2 ,则溶液M的pH一定等于7
C.若溶液M呈酸性,V1一定大于V2
D.若溶液M呈碱性,V1一定小于V2
(2)若已知在25℃,AgCl的Ksp = 1.8×10-10,现将足量AgCl分别放入:①100 mL 蒸馏水中;②100 mL 0.2mol·L-1 AgNO3溶液中;③100 mL 0.1mol·L-1 AlCl3溶液中;④100 mL 0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是 (用序号连接)
(3)若1mol SO2(g)氧化为1mol SO3(g)的ΔH =-99kJ·mol-1,单质硫的燃烧热为296kJ·mol-1,则由S(s)生成3 mol SO3(g)的ΔH =
(4)对于2NO2(g) N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。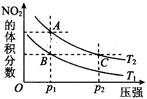
①.A、C两点的反应速率:A>C
②.A、C两点气体的颜色:A深、C浅
③.B、C两点的气体的平均分子质量:B<C
④.由状态B到状态A,可以用加热方法
(5)下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图: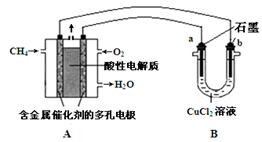
请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.2 mol电子通过时,阴极增重____g。
①HA是________(填“强电解质”或“弱电解质”);
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是________(填字母)。
A.c(H+)/c(HA) B.c(HA)/(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
③若M溶液是由上述HA溶液V1 mL与pH = 12的NaOH溶液V2 mL混合充分反应而得,则下列说法中正确的是
A.若溶液M呈中性,则溶液M中c(H+) + c(OH-) = 2.0×10-7 mol·L-1
B.若V1 =V2 ,则溶液M的pH一定等于7
C.若溶液M呈酸性,V1一定大于V2
D.若溶液M呈碱性,V1一定小于V2
(2)若已知在25℃,AgCl的Ksp = 1.8×10-10,现将足量AgCl分别放入:①100 mL 蒸馏水中;②100 mL 0.2mol·L-1 AgNO3溶液中;③100 mL 0.1mol·L-1 AlCl3溶液中;④100 mL 0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是 (用序号连接)
(3)若1mol SO2(g)氧化为1mol SO3(g)的ΔH =-99kJ·mol-1,单质硫的燃烧热为296kJ·mol-1,则由S(s)生成3 mol SO3(g)的ΔH =
(4)对于2NO2(g)
 N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
①.A、C两点的反应速率:A>C
②.A、C两点气体的颜色:A深、C浅
③.B、C两点的气体的平均分子质量:B<C
④.由状态B到状态A,可以用加热方法
(5)下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图:

请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.2 mol电子通过时,阴极增重____g。
(1)写出邻苯二甲酸氢钾与NaOH反应的化学方程式:______
(2)将用分析天平精确称量的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液无色,再加入指示剂______(从甲基橙、酚酞、石蕊中选择),用NaOH溶液滴定到终点时,现象是______.
(3)该实验要用到的主要玻璃仪器______(写二种)
(4)该学生进行三次实验,所取固体的质量均相同,填写下表:
| 实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
| 1 | 0.4162 | 18.25 |
| 2 | 17.04 | |
| 3 | 16.96 |
A.______
B.______
(5)NaOH溶液的物质的量浓度为______.

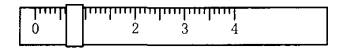
相对分子质量为204.0)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol•L-1左右,滴定终点时溶液的pH约为9.1。该生用托盘天平称量邻苯二甲酸氢钾时,在左盘放有一个1g砝码,游码位置如图所示:
(1)将称好的邻苯二甲酸氢钾放于锥形瓶中,加适量水溶解,溶液无色,再加入指示剂________(从甲基橙、酚酞、石蕊中选择)1~2滴,用NaOH溶液滴定至终点,现象是________。
(2)该生进行三次实验,所取固体质量均相同,填写下表:
实验编号 邻苯二甲酸氢钾质
量/g 待测NaOH溶液体
积/mL
1 18.20
2 17.10
3 16.90
(3)滴定中误差较大的是第________次实验,造成这种误差的可能原因是(只填三种即可):a________b________c________
(4)NaOH溶液的物质的量浓度为(只列出计算式,不必求出结果)。
查看习题详情和答案>>