摘要:14.水的电离过程为H2OH++OH-.在不同温度下其平衡常数为K=1.0×10-14.K=2.1×10-14.则下列叙述正确的是 A.c(H+)随着温度升高而降低 B.在35℃时.c(H+)>c(OH-) C.水的电离度:a D.水的电离是吸热的
网址:http://m.1010jiajiao.com/timu3_id_68905[举报]
水的电离过程为H2O H++OH-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是( )
H++OH-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是( )
A.c(H+)随着温度的升高而降低 B.在35 ℃时,c(H+)>c(OH-)
C.水的电离百分率 α(25 ℃)>α(35 ℃) D.水的电离是吸热的
查看习题详情和答案>>
水的电离过程为H2O H++OH-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14 mol2·L-2,K(35 ℃)=2.1×10-14 mol2·L-2。则下列叙述中正确的是( )?
H++OH-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14 mol2·L-2,K(35 ℃)=2.1×10-14 mol2·L-2。则下列叙述中正确的是( )?
A.[H+]随着温度的升高而降低?
B.在35 ℃时,[H+]>[OH-]?
C.水的电离百分率α(25 ℃)>α(35 ℃)?
D.水的电离是吸热的
查看习题详情和答案>>
水的电离过程为H2O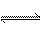 H++OH-,在不同温度下其平衡常数为K(
H++OH-,在不同温度下其平衡常数为K(25 ℃ )=1.0×10-14,K(35 ℃ )=2.1×10-14。则下列叙述正确的是( )
A.c(H+)随着温度的升高而降低 B.在
C.水的电离度α(
 H++OH-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是( )
H++OH-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是( )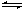 H+ + OH─,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14,则下列叙述正确的是 ( )
H+ + OH─,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14,则下列叙述正确的是 ( )