网址:http://m.1010jiajiao.com/timu3_id_68565[举报]
( )
A.CO燃烧的热化学方程式为:2CO(g)+O2(g)![]() 2CO2(g) ΔH=+282.8 kJ·mol-1
2CO2(g) ΔH=+282.8 kJ·mol-1
B.H2燃烧的热化学方程式为:2H2(g)+O2(g)![]() 2H2O(g) ΔH=-571.6 kJ·mol-1
2H2O(g) ΔH=-571.6 kJ·mol-1
C.燃烧前混合气体中H2的体积分数为50%
D.燃烧后的混合气体与足量的过氧化钠作用可产生1.25 mol氧气
查看习题详情和答案>>甲醇是一种常用的燃料,工业上可以用CO和H2在一定条件下合成甲醇。
(1)已知CO(g)、H2(g)、CH3OH(1)的燃烧热△H分别为:-283.0kJ/mol、-285.8 kJ/mol、-726.5kJ/mol,则CO合成甲醇的热化学方程式为: 。
(2)在恒容密闭容器中CO与H2发生反应生成甲醇,各物质浓度在不同条件下的变化状况如图所示(开始时氢气的浓度曲线和8分钟后甲醇的浓度曲线未画出。4分钟和8分钟改变的条件不同):

①下列说法正确的是
A.起始时n(H2)为1.7mol
B.当容器内压强恒定时,说明反应达到平衡状态
C.4分钟时,改变的条件是升高温度
D.7分钟时,v(CO)=v(CH3OH)
②计算0~2min内平均反应速率v(H2)=
③在3min时该反应的平衡常数K= (计算结果)
④在图中画出8~12min之间c(CH3OH)曲线
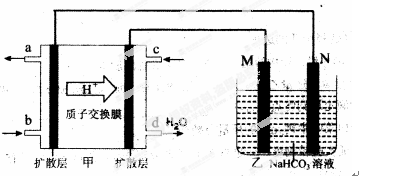
(2)2009年,中国在甲醇燃料电池技术上获得突破,组装了自呼吸电池及主动式电堆,其装置原理如图甲。

①该电池的负极反应式为: 。
②乙池是一铝制品表面“钝化”装置,两极分别为铝制品和石墨。
M电极的材料是 ,该铝制品表面“钝化”时的反应式为: 。
查看习题详情和答案>>
甲醇是一种常用的燃料,工业上可以用CO和H2在一定条件下合成甲醇。
(1)已知CO(g)、H2(g)、CH3OH(1)的燃烧热△H分别为:-283.0kJ/mol、-285.8 kJ/mol、-726.5kJ/mol,则CO合成甲醇的热化学方程式为: 。
(2)在恒容密闭容器中CO与H2发生反应生成甲醇,各物质浓度在不同条件下的变化状况如图所示(开始时氢气的浓度曲线和8分钟后甲醇的浓度曲线未画出。4分钟和8分钟改变的条件不同): 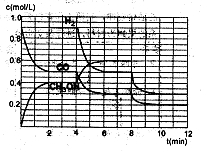
①下列说法正确的是
| A.起始时n(H2)为1.7mol |
| B.当容器内压强恒定时,说明反应达到平衡状态 |
| C.4分钟时,改变的条件是升高温度 |
| D.7分钟时,v(CO)=v(CH3OH) |
③在3min时该反应的平衡常数K= (计算结果)
④在图中画出8~12min之间c(CH3OH)曲线
(2)2009年,中国在甲醇燃料电池技术上获得突破,组装了自呼吸电池及主动式电堆,其装置原理如图甲。
①该电池的负极反应式为: 。
②乙池是一铝制品表面“钝化”装置,两极分别为铝制品和石墨。
M电极的材料是 ,该铝制品表面“钝化”时的反应式为: 。 查看习题详情和答案>>
(1)已知CO(g)、H2(g)、CH3OH(1)的燃烧热△H分别为:-283.0kJ/mol、-285.8 kJ/mol、-726.5kJ/mol,则CO合成甲醇的热化学方程式为: 。
(2)在恒容密闭容器中CO与H2发生反应生成甲醇,各物质浓度在不同条件下的变化状况如图所示(开始时氢气的浓度曲线和8分钟后甲醇的浓度曲线未画出。4分钟和8分钟改变的条件不同):

①下列说法正确的是
| A.起始时n(H2)为1.7mol |
| B.当容器内压强恒定时,说明反应达到平衡状态 |
| C.4分钟时,改变的条件是升高温度 |
| D.7分钟时,v(CO)=v(CH3OH) |
③在3min时该反应的平衡常数K= (计算结果)
④在图中画出8~12min之间c(CH3OH)曲线
(2)2009年,中国在甲醇燃料电池技术上获得突破,组装了自呼吸电池及主动式电堆,其装置原理如图甲。

①该电池的负极反应式为: 。
②乙池是一铝制品表面“钝化”装置,两极分别为铝制品和石墨。
M电极的材料是 ,该铝制品表面“钝化”时的反应式为: 。
利用太阳能分解水生成的氢气,在催化剂作用下氢气与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
(1)用太阳能分解10 mol水消耗的能量是 kJ。
(2)液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为 。
(3)
在容积为2 L的密闭容器中,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
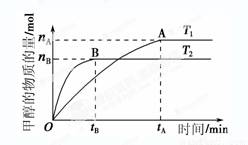
①可逆反应的平衡常数表达式K=
②下列说法正确的是
A.温度为T1时,从反应开始到平衡,生成甲醇
的平均速率为v(CH3OH)= mol·L-1·min-1
mol·L-1·min-1
B.该反应在T1时的平衡常数比T2时的小
C.该反应为放热反应
D.处于A点的反应体系从T1变到T2,达到平衡时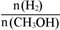 增大
增大
③在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为 ;
(4) 在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,总反应式为
2CH3OH + 3O2=2CO2+4H2O,则正极的反应式为 ;
负极的反应式为 。[来
查看习题详情和答案>>