摘要:10.(1)2NH3+2O2-NH4NO3+H2O.x/34=y/64=100/80.x=42.5 t.y=80 t.不耗水. (2)留下与HNO3反应的NH3没有损失.由(1)可知为42.5/2=21.25 t, 则另21.25 t NH3应理解为损失两次后的剩余量.即消耗NH3为:21.25/=24.06 t, 共消耗NH3的质量为:24.06+21.25=45.31 t.
网址:http://m.1010jiajiao.com/timu3_id_68541[举报]
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其步骤为:第一步,煅烧FeS2产物为SO2和Fe3O4;第二步,SO2向SO3的转化;第三步,SO3转化为硫酸.
(1)在恒温条件下,向一固定容积的密闭容器中通入一定量的SO2与O2,发生如下反应2SO2(g)+O2(g)?2SO3(g),一段时间后,能说明该反应达到平衡状态的有
a.SO2和SO3浓度相等 b.SO2百分含量保持不变c.容器中气体的压强不变
d.SO3的生成速率与SO2的生成速率相等 e.容器中混合气体的密度保持不变
(2)SO2尾气用过量的氨水吸收,对SO2可进行回收及重新利用,反应的化学方程式为
(3)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4.酸溶过程中需保持溶液足够酸性,其目的是
(4)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)?2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol?L.计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程).
查看习题详情和答案>>
(1)在恒温条件下,向一固定容积的密闭容器中通入一定量的SO2与O2,发生如下反应2SO2(g)+O2(g)?2SO3(g),一段时间后,能说明该反应达到平衡状态的有
bcd
bcd
a.SO2和SO3浓度相等 b.SO2百分含量保持不变c.容器中气体的压强不变
d.SO3的生成速率与SO2的生成速率相等 e.容器中混合气体的密度保持不变
(2)SO2尾气用过量的氨水吸收,对SO2可进行回收及重新利用,反应的化学方程式为
SO2+H2O+2NH3=(NH4)2SO3
SO2+H2O+2NH3=(NH4)2SO3
;(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O;
(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O;
(3)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4.酸溶过程中需保持溶液足够酸性,其目的是
抑制Fe2+、Fe3+的水解,防止Fe2+被氧化;
抑制Fe2+、Fe3+的水解,防止Fe2+被氧化;
.(4)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)?2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol?L.计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程).
1.6×103L/mol;80%
1.6×103L/mol;80%
.合理利用化学反应可以造福人类.请写出下列反应的化学方程式.
(1)工业制取漂白粉的化学方程式(用单线桥标出电子转移的方向和数目)
 .洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂,用化学方程式表示漂白粉溶于水后在空气中产生漂白性物质的反应
.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂,用化学方程式表示漂白粉溶于水后在空气中产生漂白性物质的反应
(2)燃煤锅炉将排放大量SO2,污染大气造成公害,常采用两种方法消除燃煤SO2的污染.
使排放的烟气通过氨水洗涤,化学方程式是
查看习题详情和答案>>
(1)工业制取漂白粉的化学方程式(用单线桥标出电子转移的方向和数目)


Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO
Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO
.(2)燃煤锅炉将排放大量SO2,污染大气造成公害,常采用两种方法消除燃煤SO2的污染.
使排放的烟气通过氨水洗涤,化学方程式是
SO2(少量)+H2O+2NH3═(NH4)2SO3 或SO2(过量)+H2O+NH3═NH4HSO3
SO2(少量)+H2O+2NH3═(NH4)2SO3 或SO2(过量)+H2O+NH3═NH4HSO3
.(2011?陕西一模)已知A为一无机盐,C、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、H、L为高中常见的单质,I为常见无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验.
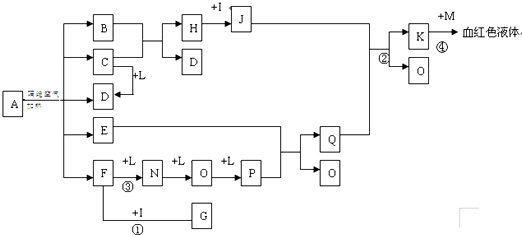
(1)写出G的电子式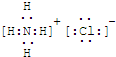
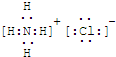 ,M的化学式
,M的化学式
(2)写出反应②的离子反应方程式
(3)写出反应③的化学反应方程式
(4)用石墨电极电解溶液K时,电解初始阶段电极反应方程式为:
阴极
阳极
(5)已知A在隔绝空气条件下分解产生的各产物的物质的量之比为B:C:D:E:F=1:2:2:2:2,写出A分解的反应方程式
查看习题详情和答案>>

(1)写出G的电子式
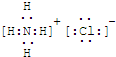
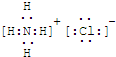
KSCN
KSCN
;(2)写出反应②的离子反应方程式
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
;(3)写出反应③的化学反应方程式
4NH3+3O2=2N2+6H2O
4NH3+3O2=2N2+6H2O
;反应①④中属于非氧化还原反应的是①④
①④
;(4)用石墨电极电解溶液K时,电解初始阶段电极反应方程式为:
阴极
2Fe3++2e=2Fe2+
2Fe3++2e=2Fe2+
阳极
2Cl--2e=Cl2↑
2Cl--2e=Cl2↑
(5)已知A在隔绝空气条件下分解产生的各产物的物质的量之比为B:C:D:E:F=1:2:2:2:2,写出A分解的反应方程式
(NH4)2Fe(C2O4)2=FeO+2CO↑+2CO2↑+2H2O+2NH3↑
(NH4)2Fe(C2O4)2=FeO+2CO↑+2CO2↑+2H2O+2NH3↑
.弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于动态平衡.
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-?H++A2-.
①NaHA溶液
②已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)?Ca2+(aq)+A2-(aq)△H>0.降低温度时,Ksp
(2)已知水的电离方程式可写为2H2O?H3O++OH-,液氨类似于水的电离,则液氨的电离方程式为
(3)常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是
(4)氨气溶于水得到氨水,在25℃下,将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,则用含a和b的代数式表示出该混合溶液中氨水的电离平衡常数
×10-7
×10-7.
查看习题详情和答案>>
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-?H++A2-.
①NaHA溶液
显酸性
显酸性
(选填“显酸性”、“显碱性”、“显中性”或“无法确定”).②已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)?Ca2+(aq)+A2-(aq)△H>0.降低温度时,Ksp
减小
减小
(填“增大”、“减小”或“不变”,下同);滴加少量浓盐酸,c(Ca2+)增大
增大
.(2)已知水的电离方程式可写为2H2O?H3O++OH-,液氨类似于水的电离,则液氨的电离方程式为
2NH3?NH2-+NH4+
2NH3?NH2-+NH4+
;在液氨中加入NH4Cl,则平衡将向逆向
逆向
移动(填“正向”或“逆向”).(3)常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是
1×1010
1×1010
.(4)氨气溶于水得到氨水,在25℃下,将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,则用含a和b的代数式表示出该混合溶液中氨水的电离平衡常数
| b |
| a-b |
| b |
| a-b |