摘要:6.23.04 g Ca(OH)2.CaCO3.CaO.CaSO3固体混合物恰好和189.8 g 10%的盐酸溶液反应.反应后溶液重206.16 g.则所得溶液溶质的质量分数是 %.14%.
网址:http://m.1010jiajiao.com/timu3_id_68521[举报]
标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0.2 mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3 g。则下列关于该过程的推断不正确的是
A.混合气体中氯气物质的量为0.04 mol??
B.混合气体中SO2物质的量为0.04 mol
C.所得的沉淀为0.1 mol BaSO4???????
D.a的取值范围为1.344< a <1.792
查看习题详情和答案>>
含有Ca2+、Mg2+、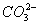 的水在加热过程中会发生如下反应而形成水垢:
的水在加热过程中会发生如下反应而形成水垢:
Ca(HCO3)2![]() CaCO3↓+CO2↑+H2O,
CaCO3↓+CO2↑+H2O,
Mg(HCO3)2![]() MgCO3↓+CO2↑+H2O
MgCO3↓+CO2↑+H2O
MgCO3+H2O![]() Mg(OH)2+CO2↑
Mg(OH)2+CO2↑
某学生为研究水垢的成分,取一定量水垢经加热使其失去结晶水并干燥后称得质量为
(1)通过计算确定水垢中是否含有碳酸镁。
(2)残留固体经冷却后称得质量为
(1)发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水.
已知:N2(g)+2O2(g)=2NO2(g)△H=67.7kJ?mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ?mol-1
H2(g)+
F2(g)=HF(g)△H=-269kJ?mol-1
H2(g)+
O2(g)=H2O(g)△H=-242kJ?mol-1
①肼和NO2反应的热化学方程式为
②有人认为若用氟气代替NO2作氧化剂,则反应释放的能量更大,肼和氟气反应的热化学方程式为:
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高.一个电极通入空气,另一个电极通入汽油蒸汽.其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆) 固体,它在高温下能传导O2-离子.以戊烷(C5H12)代表汽油,完成下列问题:
①电池反应方程式为
②放电时固体电解质里的O2-离子的移动方向是向
③以此电源电解足量的CuSO4溶液,当阳极产生气体0.56L(已换算为标况)时,阴极产物的质量为
查看习题详情和答案>>
已知:N2(g)+2O2(g)=2NO2(g)△H=67.7kJ?mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ?mol-1
| 1 |
| 2 |
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
①肼和NO2反应的热化学方程式为
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1153.7 kJ?mol-1
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1153.7 kJ?mol-1
.②有人认为若用氟气代替NO2作氧化剂,则反应释放的能量更大,肼和氟气反应的热化学方程式为:
N2H4(g)+2F2(g)=N2(g)+4HF(g)△H=-1135 kJ?mol-1
N2H4(g)+2F2(g)=N2(g)+4HF(g)△H=-1135 kJ?mol-1
.(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高.一个电极通入空气,另一个电极通入汽油蒸汽.其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆) 固体,它在高温下能传导O2-离子.以戊烷(C5H12)代表汽油,完成下列问题:
①电池反应方程式为
C5H12+8O2→5CO2+6H2O
C5H12+8O2→5CO2+6H2O
;②放电时固体电解质里的O2-离子的移动方向是向
负
负
极移动(填“正”或“负”);③以此电源电解足量的CuSO4溶液,当阳极产生气体0.56L(已换算为标况)时,阴极产物的质量为
3.2
3.2
g,若电解后溶液体积为1L,则溶液的pH约为1
1
,电解过程中燃料电池内转移的电子为0.1
0.1
mol. 用NA表示阿伏加德罗常数的值,下列说法中不正确的是( )
用NA表示阿伏加德罗常数的值,下列说法中不正确的是( )