网址:http://m.1010jiajiao.com/timu3_id_68477[举报]
|
科学家引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg[c(H+)/c(OH一)].常温下,在AG=10的溶液中能大量共存的离子是 | |
| [ ] | |
A. |
Mg2+、K+、Cl-、SO42- |
B. |
NH4+、Fe2+、Cl-、NO3-- |
C. |
Na+、K+、ClO--、S2- |
D. |
Na+、S2O32-、AlO2-、K+ |
|
用pH大小表示溶液的酸碱性相对强弱有许多不足之处.因此,荷兰科学家HenK VanLubeek引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH-)比值的对数,用公式表示为AG=lg | |
| [ ] | |
A. |
Na+、K+、Cl-、F- |
B. |
Na+、K+、ClO-、S2- |
C. |
|
D. |
Na+、K+、CO3 2-、 |
|
用pH大小表示溶液的酸碱性相对强弱有许多不足之处.因此,荷兰科学家HenkVan Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg[c(H+)/c(OH一)].常温下,在AG=10的溶液中能大量共存的离子是 | |
| [ ] | |
A. |
Fe2+、K+、Cl-、NO3- |
B. |
NH4+、Fe2+、I一、SO42- |
C. |
Na+、K+、ClO-、S2- |
D. |
Na+、S2O32-、AlO2-、K+ |
用pH大小表示溶液的酸碱性相对强弱有许多不足之处。荷兰科学家Henk Van Lubeck 引入了酸度(AG)的概念,即把酸度定义为c ( H+ )与c ( OH- )比值的对数,用公式表示为AG = lg[c( H+ )/c( OH- )] 。下列有关叙述中,正确的是( )
A.在25℃时,AG = 10的溶液呈碱性
B.在25℃时,若溶液呈中性,则pH =7,AG = 1
C.在25℃时,溶液的pH与AG的换算公式为AG = 2(7-pH)
D.在25℃时,0.1 mo1·L—1 NaOH溶液AG = 0
查看习题详情和答案>>
用pH大小表示溶液的酸碱性相对强弱有许多不足之处。荷兰科学家Henk Van Lubeck 引入了酸度(AG)的概念,即把酸度定义为c( H+ )与c( OH-)比值的对数,用公式表示为AG = lg[c( H+ )/c( OH-)] 。下列有关叙述中,正确的是( )
| A.在25℃时,AG = 10的溶液呈碱性 |
| B.在25℃时,若溶液呈中性,则pH =7,AG = 1 |
| C.在25℃时,溶液的pH与AG的换算公式为AG = 2(7-pH) |
| D.在25℃时,0.1 mo1·L—1 NaOH溶液AG = 0 |
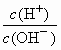 .常温下,AG=10的溶液中能大量共存的离子组是
.常温下,AG=10的溶液中能大量共存的离子组是