摘要:2.纯净的NaCl可得14.35 g沉淀.所以杂质中含氯量较高. KCl.Ca1/2Cl.Mg1/2Cl 5H2O.Al1/3Cl.
网址:http://m.1010jiajiao.com/timu3_id_68469[举报]
为了除去粗盐中的Ca2+,Mg2+,SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序 ①过滤; ②加过量NaOH溶液; ③加过量盐酸; ④加过量NaCO3溶液; ⑤加过量
BaCl2溶液
BaCl2溶液
[ ]
A.④②⑤
B.②⑤④①③
C.④①②⑤③
D.①④②⑤③
查看习题详情和答案>>
B.②⑤④①③
C.④①②⑤③
D.①④②⑤③
(1)为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序
①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液
(2)判断BaCl2已过量的方法是
(3)第④步中,写出相应的离子方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
(4)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
(5)为检验精盐纯度,需配制250mL 0.2mol/L NaCl(精盐)溶液,题图是该同学转移溶液的示意图,图中的错误是

查看习题详情和答案>>
②⑤④①③
②⑤④①③
.(填序号)①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液
(2)判断BaCl2已过量的方法是
取第②步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(或其它合理的方法)
取第②步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(或其它合理的方法)
(3)第④步中,写出相应的离子方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓
Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓
.(4)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
.(5)为检验精盐纯度,需配制250mL 0.2mol/L NaCl(精盐)溶液,题图是该同学转移溶液的示意图,图中的错误是
未用玻璃棒引流,未采用250mL容量瓶
未用玻璃棒引流,未采用250mL容量瓶
.
加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应.
(1)工业生产碘酸钾的流程如下:
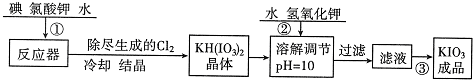
已知步骤①反应器中发生的反应为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.其中KH(IO3)2中I元素的化合价是
操作③得到碘酸钾晶体的方法是
(2)加碘食盐中碘元素的测定.
①已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-
学生甲设计的实验步骤如下:
步骤1:准确称取w g食盐,加适量蒸馏水使其完全溶解;
步骤2:用稀硫酸酸化所得食盐溶液,加入过量KI溶液充分混合;
步骤3:以淀粉为指示剂,逐滴加入2.0×10-3 mol?L-1的Na2S2O310.0mL,恰好反应完全.则食盐样品中的碘元素含量是
(或写成
)
(或写成
)mg?kg-1(以含w的代数式表示).
②学生乙另取纯净的NaCl进行了下列实验:
实验中产生蓝色现象的可能原因是
③根据学生乙的实验结果,学生甲测得的食盐中碘元素的含量可能
查看习题详情和答案>>
(1)工业生产碘酸钾的流程如下:

已知步骤①反应器中发生的反应为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.其中KH(IO3)2中I元素的化合价是
+5
+5
.碘酸钾的溶解度见表:| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100gH2O | 8.08 | 12.6 | 18.3 | 24.8 |
降温结晶
降温结晶
.(2)加碘食盐中碘元素的测定.
①已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-
学生甲设计的实验步骤如下:
步骤1:准确称取w g食盐,加适量蒸馏水使其完全溶解;
步骤2:用稀硫酸酸化所得食盐溶液,加入过量KI溶液充分混合;
步骤3:以淀粉为指示剂,逐滴加入2.0×10-3 mol?L-1的Na2S2O310.0mL,恰好反应完全.则食盐样品中的碘元素含量是
| 1270 |
| 3w |
| 423.33 |
| w |
| 1270 |
| 3w |
| 423.33 |
| w |
②学生乙另取纯净的NaCl进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| 步骤1 | 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 步骤2 | 滴入5滴淀粉溶液和1mL0.1 mol?L-1KI溶液,振荡. | 溶液无变化 |
| 步骤3 | 然后再滴入1滴1 mol?L-1的H2SO4,振荡. | 溶液变蓝色 |
4I-+4H++O2=2I2+2H2O
4I-+4H++O2=2I2+2H2O
(用离子方程式表示).③根据学生乙的实验结果,学生甲测得的食盐中碘元素的含量可能
偏高
偏高
(填“偏高”、“偏低”或“准确”).原因是过量的I-会被空气中的氧气氧化为I2
过量的I-会被空气中的氧气氧化为I2
.
(1)要除去氯化钠里混有的少量溴化钠和碘,可先将固体混合物___________,使碘___________,把碘除去;再将处理过的残渣溶于水,向溶液中先____________________,充分反应后,再加入适量的_____________,分层后进行___________操作,最后将溶液蒸发结晶,即得纯净的NaCl。
(2)盛放溴水的试剂瓶不能用橡胶塞,其原因是____________________;装碘的瓶子不能用铁盖,其原因是_____________________________;不能用自来水配制碘化钾溶液,其原因是_____________________________________________________________________。
查看习题详情和答案>>
为了将混有Na2SO4、NaHCO3的NaCl提纯,并制得纯净的NaCl溶液,某学生设计了如图所示的实验方案:?
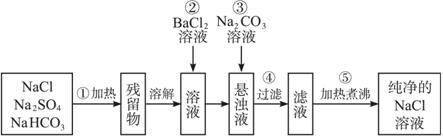
(1)操作①盛放药品可选用________。(填仪器名称)
(2)操作②为什么不用Ba(NO3)2溶液,其理由是________________________________________。?
(3)进行操作②后,如何判断SO![]() 已除尽?方法是________________________________。
已除尽?方法是________________________________。
(4)操作③的目的是_______;为何不先过滤后加Na2CO3溶液,其理由是________________。?
(5)此设计方案是否严密?请说明理由________________。??
查看习题详情和答案>>