摘要:3.A.B.C:3x.5x.7x,M=3x×7/15+5x×5/15+7x×3/15=67x/15.
网址:http://m.1010jiajiao.com/timu3_id_68384[举报]
溶液的配制过程能引起浓度偏高的是( )
①用1g 98%的浓硫酸加4g水配19.6%的硫酸
②配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线.
③10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液
④在80mL水中加入18.4mol/L的硫酸20mL,配制3.68mol/L的硫酸溶液
⑤质量分数为5x%和x%的两种氨水等体积混合配成3x%的氨水.
①用1g 98%的浓硫酸加4g水配19.6%的硫酸
②配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线.
③10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液
④在80mL水中加入18.4mol/L的硫酸20mL,配制3.68mol/L的硫酸溶液
⑤质量分数为5x%和x%的两种氨水等体积混合配成3x%的氨水.
| A、①③⑤ | B、②④⑤ | C、③④ | D、④⑤ |
Ⅰ某温度下,密闭容器中充入1mol N2和3mol H2,使之反应合成NH3,平衡后,测得NH3的体积分数为w,如果温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为w,N2、H2、NH3的物质的量分别用x、y、z表示.
(1)恒温恒容条件下:若x=0.75mol,则y=
(2)恒温恒压条件下,x、y、z(均不小于0)满足的一般条件是
Ⅱ一定条件下,可逆反应X(g)+Y(g) 2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)=0.1mol/L; c (Z)=1.6mol/L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是
2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)=0.1mol/L; c (Z)=1.6mol/L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是
Ⅲ在10℃和4×105Pa的条件下,当反应aA(g) dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
(1)压强从4×105Pa增加到6×105Pa时,平衡向
(2)压强从10×105Pa增加到20×105Pa时,平衡向
查看习题详情和答案>>
(1)恒温恒容条件下:若x=0.75mol,则y=
2.25
2.25
,z=0.5
0.5
.(2)恒温恒压条件下,x、y、z(均不小于0)满足的一般条件是
x:y=1:3
x:y=1:3
.Ⅱ一定条件下,可逆反应X(g)+Y(g)
 2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)=0.1mol/L; c (Z)=1.6mol/L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是
2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)=0.1mol/L; c (Z)=1.6mol/L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是a=b+0.4
a=b+0.4
,a的取值范围为0.4≤a≤1.3
0.4≤a≤1.3
Ⅲ在10℃和4×105Pa的条件下,当反应aA(g)
 dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:| 压强(Pa) | 4×105 | 6×105 | 10×105 | 20×105 |
| D的浓度(mol/L) | 0.085 | 0.126 | 0.200 | 0.440 |
逆
逆
(填“正”或“逆”)方向移动,理由是压强从4×105Pa到6×105Pa时,增加为原来的1.5倍,而c(D)=6/4×0.085mol/L=0.128mol/L>0.126,所以实际平衡向逆反应方向移动
压强从4×105Pa到6×105Pa时,增加为原来的1.5倍,而c(D)=6/4×0.085mol/L=0.128mol/L>0.126,所以实际平衡向逆反应方向移动
(2)压强从10×105Pa增加到20×105Pa时,平衡向
正
正
(填“正”或“逆”)方向移动.化学反应与能量有比不可分的关系,回答下列问题.
Ⅰ:已知31g白磷变为31g红磷释放能量.试回答:
(1)上述变化属于
(2)31g白磷具有的能量_
(3)31g白磷完全燃烧释放的能量_
Ⅱ:A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
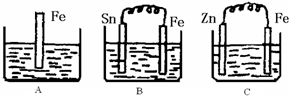
(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A
(2)一段时间后,B中Sn极附近溶液的pH
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度=
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是
Ⅲ:某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空: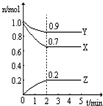
(1)该反应的化学方程式为
(2)反应开始至2min,以气体Z表示的平均反应速率为
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时
查看习题详情和答案>>
Ⅰ:已知31g白磷变为31g红磷释放能量.试回答:
(1)上述变化属于
化学
化学
(填“物理”或“化学”)变化.(2)31g白磷具有的能量_
>
>
(“>”或“<”)31g红磷具有的能量,常温常压下,红磷
红磷
更稳定.(3)31g白磷完全燃烧释放的能量_
>
>
(“>”或“<”)31g红磷完全燃烧释放的能量.Ⅱ:A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸

(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A
Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
;BFe-2e-═Fe2+
Fe-2e-═Fe2+
;C2H++2e-═H2↑
2H++2e-═H2↑
.(2)一段时间后,B中Sn极附近溶液的pH
pH增大
pH增大
(填“增大”、“减小”、“不变”).(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度=
0.75
0.75
mol?L-1.此时,三个烧杯中液体质量由大到小的顺序为:C>A=B
C>A=B
(填写序号).(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是
BAC
BAC
(填写序号).Ⅲ:某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:

(1)该反应的化学方程式为
3X+Y 2Z
2Z
 2Z
2Z3X+Y 2Z
2Z
. 2Z
2Z(2)反应开始至2min,以气体Z表示的平均反应速率为
0.05mol/(L.min)
0.05mol/(L.min)
.(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的
0.9
0.9
倍;②达平衡时,容器内混合气体的平均相对分子质量比起始投料时
增大
增大
(填“增大”“减小”或“相等”).