摘要:4.+6M2++14H+¾®2R3++6M3++7H2O.由得失电子守恒可直接得出x=6.更为简便. 规律法巧解
网址:http://m.1010jiajiao.com/timu3_id_68352[举报]
单质A、B、C分别为固体、黄绿色气体和无色气体,在一定条件下它们的反应如图所示.
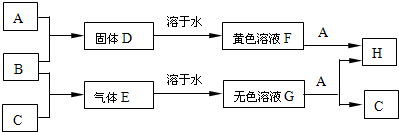
(1)B的化学式为
(2)A与B反应的化学方程式为
(3)将B通入NaOH溶液中反应的离子方程式为
(4)F、G、H三种溶液中所含的相同阴离子是
查看习题详情和答案>>

(1)B的化学式为
Cl2
Cl2
,C在充满B的集气瓶中燃烧时的现象是安静燃烧,发出苍白色火焰
安静燃烧,发出苍白色火焰
.(2)A与B反应的化学方程式为
2Fe+3Cl2
2FeCl3
| ||
2Fe+3Cl2
2FeCl3
.溶液F与A反应的离子方程式为
| ||
Fe+2Fe3+=3Fe2+
Fe+2Fe3+=3Fe2+
.(3)将B通入NaOH溶液中反应的离子方程式为
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.(4)F、G、H三种溶液中所含的相同阴离子是
Cl-
Cl-
,检验该阴离子可用的试剂是先用稀硝酸酸化,再滴加硝酸银溶液,若产生白色沉淀,则原溶液中含有氯离子
先用稀硝酸酸化,再滴加硝酸银溶液,若产生白色沉淀,则原溶液中含有氯离子
.将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好
最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况.以下情况相同.)
(1)生成沉淀的质量刚好最大时,反应的方程式为:
(2)原混合物中Ca(OH)2的质量为
(3)沉淀恰好溶解时,消耗CO2的体积为
(4)写出溶液中生成沉淀的质量m(g)与通入CO2的体积V(mL)之间的函数表达式.
(5)在图示坐标系上,画出生成沉淀的质量m(g)与通入CO2的体积V(mL)的关系曲线.
查看习题详情和答案>>
最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况.以下情况相同.)
(1)生成沉淀的质量刚好最大时,反应的方程式为:
CO2+Ca(OH)2=CaCO3↓+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
(2)原混合物中Ca(OH)2的质量为
0.74g
0.74g
g.(3)沉淀恰好溶解时,消耗CO2的体积为
896
896
mL(4)写出溶液中生成沉淀的质量m(g)与通入CO2的体积V(mL)之间的函数表达式.
| V的取值范围 | m=f(V) |

在某次实验中,要用500mL 0.52mol?L-1的NaOH溶液,回答下列问题:
(1)配制NaOH溶液时需用的主要仪器有托盘天平(附砝码、镊子)、药匙、量筒、烧杯、胶头滴管、
(2)下列操作对所配浓度有何影响(填写字母)?
偏大的有
A、称量时用了生锈的砝码;
B、将NaOH放在纸张上称量;
C、NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D、往容量瓶转移时,有少量液体溅出;
E、定容时俯视刻度线;
F、容量瓶未干燥即用来配制溶液;
G、定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线.
查看习题详情和答案>>
(1)配制NaOH溶液时需用的主要仪器有托盘天平(附砝码、镊子)、药匙、量筒、烧杯、胶头滴管、
玻璃棒
玻璃棒
和500mL的容量瓶
500mL的容量瓶
;(2)下列操作对所配浓度有何影响(填写字母)?
偏大的有
A、C、E
A、C、E
;偏小的有B、D、G
B、D、G
.A、称量时用了生锈的砝码;
B、将NaOH放在纸张上称量;
C、NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D、往容量瓶转移时,有少量液体溅出;
E、定容时俯视刻度线;
F、容量瓶未干燥即用来配制溶液;
G、定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线.
组成生命细胞的11种常量元素(约占人体总质量的99.97%),全部位于周期表的前20号.其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素.
(1)这六种元素中除H、C、O、P、S外,应该还有
(2)CO2是一种温室气体,它的电子式为
 ,将其转变其他化工原料,必须破坏的化学键属于
,将其转变其他化工原料,必须破坏的化学键属于
(3)元素周期表中元素的性质存在递变规律,下列关系正确的是
a.离子半径:S2->Na+>O2->H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原性:PH3>H2S>HCl>HF
(4)下表为部分非金属元素与氢形成共价键的键长与键能数据:
根据表中数据,归纳共价键键能与键长的关系
查看习题详情和答案>>
(1)这六种元素中除H、C、O、P、S外,应该还有
N
N
(写元素符号),它的基态原子核外电子排布式是1s22s22p3
1s22s22p3
,其第一电离能比O的大
大
(填“大”或“小”);与它同周期,且单质熔点最高的元素在周期表中的位置第二周期,IVA族
第二周期,IVA族
.(2)CO2是一种温室气体,它的电子式为


极性
极性
(填“极性”或“非极性”)键.(3)元素周期表中元素的性质存在递变规律,下列关系正确的是
d
d
(填序号).a.离子半径:S2->Na+>O2->H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原性:PH3>H2S>HCl>HF
(4)下表为部分非金属元素与氢形成共价键的键长与键能数据:
| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
同类分子中(同主族元素原子与相同其他原子等合理均可),键长越小,键能越大
同类分子中(同主族元素原子与相同其他原子等合理均可),键长越小,键能越大
.下表是周期表中的一部分,根据A-K在周期表中的位置,按要求回答下列问题:
(1)上表A-K元素中,只有负价而无正价的元素是(写出元素名称,下同)
(2)比较D-、E+及K-的离子半径,由大到小的顺序为:
(3)气态氢化物最稳定的是(填物质的化学式)
(4)(本小题均填物质的化学式)在最高价氧化物的水化物中,碱性最强的是(填物质的化学式,下同)
查看习题详情和答案>>
| 族周期 | ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 | A | |||||||
| 2 | B | C | D | |||||
| 3 | E | F | G | H | I | J | K |
氟
氟
,金属性最强的元素是钠
钠
,原子半径最小的元素是氢
氢
.(2)比较D-、E+及K-的离子半径,由大到小的顺序为:
Cl->F->Na+
Cl->F->Na+
(3)气态氢化物最稳定的是(填物质的化学式)
HF
HF
.写出元素 C、K的气态氢化物相互反应的现象产生白烟
产生白烟
,反应化学方程式为:NH3+HCl═NH4Cl
NH3+HCl═NH4Cl
.(4)(本小题均填物质的化学式)在最高价氧化物的水化物中,碱性最强的是(填物质的化学式,下同)
NaOH
NaOH
,酸性最强的是HClO4
HClO4
,呈两性的是Al(OH)3
Al(OH)3
.